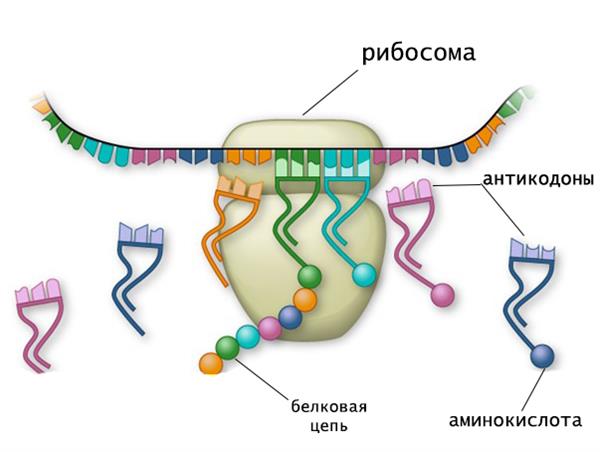
Третинна структура молекули
“Лист конюшини” є вторинною структурою тРНК, однак за рахунок фолдинга молекула набуває L-подібну конформацію, яка скріплюється додатковими водневими зв’язками.
L-форма являє собою третинну структуру тРНК і складається з двох практично перпендикулярних А-РНК спіралей, що мають довжину 7 нм і товщину 2 нм. Така форма молекули має всього 2 кінця, на одному з яких розташований антикодон, а на іншому – акцепторний центр.
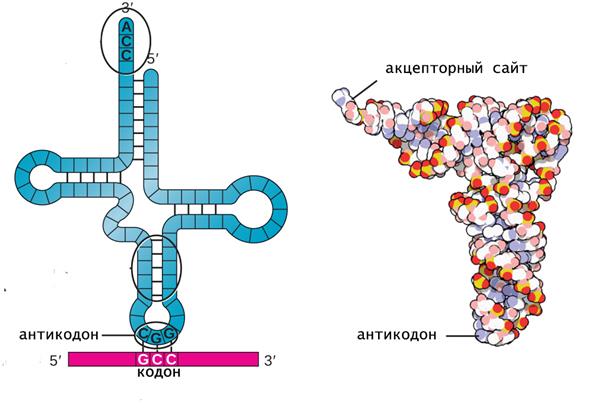
Особливості зв’язування тРНК з амінокислотою
Активацію амінокислот (їх приєднання до транспортної РНК) здійснює аминоацил-тРНК-синтетаза. Цей фермент одночасно виконує 2 важливі функції:
- каталізує утворення ковалентного зв’язку між 3`-гідроксильної групою акцепторної стебла і амінокислотою;
- забезпечує принцип виборчого відповідності.
Для кожної з 20 амінокислот є своя аминоацил-тРНК-синтетаза. Вона може взаємодіяти тільки з відповідним видом транспортної молекули. Це означає, що антикодон останній повинен бути комплементарен триплету, кодирующему саме цю амінокислоту. Наприклад, синтетаза лейцину буде з’єднуватися тільки з назначеним для лейцину тРНК.
В молекулі аминоацил-тРНК-синтетази є три нуклеотид-зв’язуючих кишені, конформація і заряд яких комплементарны нуклеотидам відповідного антикодона в тРНК. Таким чином, фермент визначає потрібну транспортну молекулу. Набагато рідше фрагментом впізнання служить нуклеотидна послідовність акцепторної стебла.