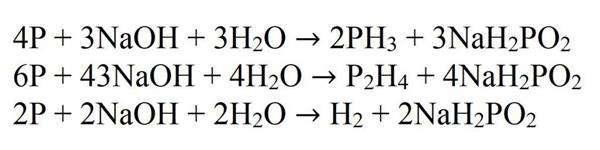Фосфін — це отруйний газ, який в чистому вигляді не має кольору і запаху. З хімічної точки зору, є летючим водневих сполук фосфору. У хімії формула фосфіну має вигляд — PH3. За своїми властивостями має деякі подібності з аміаком. Речовина дуже небезпечно, так як має високу токсичність і схильність до самозаймання.
Отримання
Найбільш добре вивчений спосіб отримання фосфіну — це реакція взаємодії білого фосфору з розчином сильної луги при нагріванні. В даному випадку фосфор диспропорционирует на метафосфат і фосфін. Побічними продуктами цієї реакції є дифосфин (P2H4) і водень, тому вихід даної реакції невеликий і становить не більше 40 %.
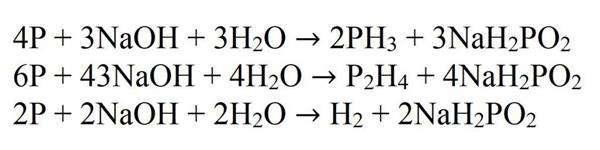
Утворюється дифосфин в реакційній середовищі вступає у взаємодію з лугом, в результаті чого утворюється фосфін і водень.
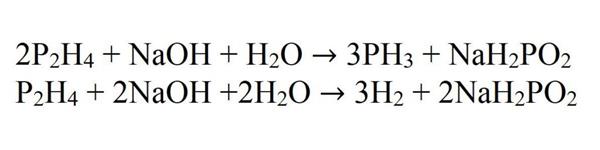
А отриманий у цих реакціях гипофосфит, при взаємодії з лугом, переходить в фосфат з виділенням водню.
NaH2PO2 + 2NaOH = 2H2 + na 3 po 4
Після завершення всіх реакцій, в результаті взаємодії лугу на фосфор утворюється фосфін, водень і фосфат. Даний спосіб отримання можна також провести з лужними оксидами замість лугів. Цей досвід є дуже гарним, так як утворюється дифосфин відразу ж спалахує і згорає у вигляді іскор, утворюючи щось схоже на феєрверк.
При впливі води або кислоти на фосфіди металів також виходить фосфін.
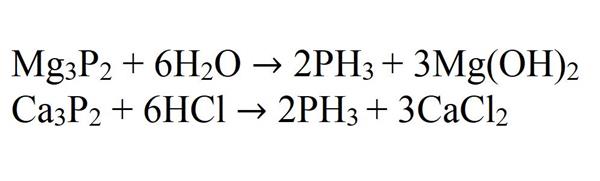
При термічному розкладанні фосфористої кислоти або її відновлення воднем у момент виділення також утворюється фосфін.
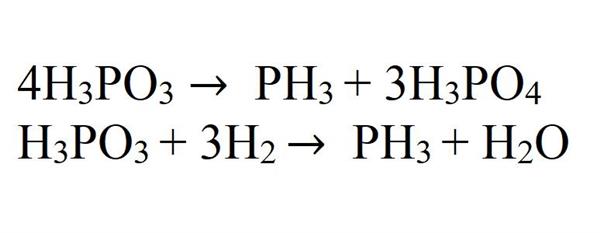
Солі фосфония при розкладанні або в реакції з деякими речовинами дають фосфін.
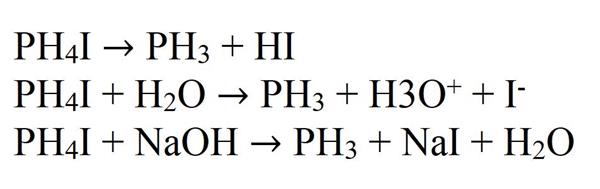
Фізичні властивості
Фосфін являє собою безбарвний газ без запаху. Але технічний фосфін (з деякими домішками) може мати характерний неприємний запах, який описують по-різному. Трохи важчий за повітря, при температурі -87,42 °C зріджується, а при -133,8 °C стає твердим речовиною. Такі низькі температури кипіння і плавлення обумовлені досить слабкими водневими зв’язками. Речовина практично нерозчинна у воді, але при певних умовах утворює з водою нестійкі гідрати. Добре розчинний в етанолі і діетиловому ефірі. Щільність фосфіну при нормальних умовах становить 0,00153 г/см3.
Хімічні властивості
Як вже було сказано, хімічна формула фосфіну – PH3. Хоч фосфін і схожий на аміак, він має ряд відмінностей у взаємодіях з іншими речовинами. Ці особливості обумовлені тим, що хімічні зв’язки в фосфине (по формулі це стає ясно) ковалентні слабополярные. Вони менш полярні, ніж в аміаку, і тому більш міцні.
При сильному нагріванні (приблизно 450 °C) без доступу кисню фосфін розкладається на прості речовини.
2PH3 → 2P + 3H2
При температурі понад 100 °C PH3 самозаймається, вступаючи в реакцію з киснем повітря. Температурний поріг можна знизити ультрафіолетовим світлом. З цієї причини, що виділяється на болотах фосфін, часто самозаймається, викликаючи появу так званих «блукаючих вогнів».
PH3 + 2 O 2 → H3PO4
Але може відбуватися і просте горіння. Тоді утворюється фосфорний ангідрид і вода.
2PH3 + 4O2 → P2O5 + 3H2O
Як і аміак, фосфін може утворювати солі, взаємодіючи з галогеноводородами.
PH3 + HI→ PH4I
PH3 + HCl→ PH4Cl
Виходячи з формули фосфіну, можна сказати, що фосфор у ньому має нижчу ступінь окислення. З цієї причини він є добрим відновником.
PH3 + 2I2+ 2H2O → H3PO2 + 4HI
PH3 + 8HNO3→ H3PO4 + 8NO2 + 4H 2 O
Застосування
Через свою високу токсичність, фосфін знайшов застосування в фумігації, тобто знищення різного роду шкідників (комах, гризунів) за допомогою газу. Для цих процедур існують спеціальні пристрої — машини-фумігатори, з використанням яких розпилюють газ у приміщеннях. Зазвичай фосфіном або препаратів на його основі обробляють склади зернових культур, готових харчових продуктів, меблів, а також бібліотеки, заводські приміщення, вагони поїздів та інший транспорт. Перевага такої обробки в тому, що фосфін навіть у невеликих концентраціях легко проникає у важкодоступні місця і ніяк не взаємодіє з металами, деревиною і тканиною.
Приміщення обробляють фосфіном, у герметичному стані його тримають протягом 5-7 діб. Після цього не менше двох діб потрібно здійснювати провітрювання, інакше знаходиться людині в ньому небезпечно. Після цього фосфін не залишає ніяких слідів навіть на продукти, зерно та інші товари.
Ще фосфін використовується в синтезі деяких речовин, особливо органічних. Також з нього може виходити хімічно чистий фосфор, з використанням фосфіну виробляють легування напівпровідників.
Токсикологія
Фосфін вкрай токсичне з’єднання. Він швидко проходить через дихальні шляхи і взаємодіє зі слизовими оболонками організму. Це може викликати порушення роботи нервової системи, а також обміну речовин в цілому. Ознаками отруєння можуть служити запаморочення, нудота, блювота, головний біль, втома, іноді навіть конвульсії. У важких випадках відправлення людина може втратити свідомість або відбутися зупинка дихання і серцебиття. Гранично допустима концентрація фосфіну в повітрі — 0.1 мг/м3. Концентрація 10 мг/м3 відразу призводить до летального результату.
Перше, що необхідно зробити з постраждалим від отруєння фосфіну, — винести на свіже повітря, звільнити від забрудненого одягу. Також рекомендується облити потерпілого водою, щоб швидше прибрати залишки токсичного газу. Стаціонарне лікування передбачає використання кисневої маски, контроль серцевого ритму та стану печінки, лікування набряку легенів. За хворим необхідно стежити мінімум 2-3 доби, навіть якщо видимих ознак отруєння вже немає. Деякі симптоми можуть проявлятися лише через кілька діб після контакту з фосфіном.