Калій є хімічним елементом, якому в періодичній таблиці Менделєєва Д. І. відповідає символ “K” (з лат. Kalium) і номер 19. З арабської мови назва цього елемента перекладається як “зола рослин”. Метал володіє яскравими лужними властивостями, має біло-сріблястий колір і поширений в природі в солоній воді і мінералах. Хімічна активність металу досить висока, він легко окислюється на повітрі. Існує велике число ізотопів калію, які використовуються в різних областях діяльності людини.

Що таке атомні ізотопи?
Перед розглядом питання про изотопах калію пояснимо термін “ізотоп”. Під ізотопами конкретного атома хімічного елемента розуміється набір атомів, які мають один і той же номер у періодичній системі Менделєєва, але відрізняються один від одного масою ядер. При цьому число протонів у всіх ядрах ізотопів даного елементу є однаковим. Відрізняється лише число нейтронів.
Сам термін “ізотоп” веде своє походження з грецької мови і складається з двох слів: isos – рівний і topos – місце. Вперше цей термін почав використовуватись на початку XX століття англійським ученим Фредеріком Содді, який увійшов в історію хімії, як дослідник радіоактивності атомів і природи ізотопів різних елементів. За свої заслуги Содді отримав Нобелівську премію в 1921 році з хімії.
Зазначимо, що більшість хімічних елементів мають більше одного ізотопу. Всього 8 елементів періодичної таблиці володіють одним ізотопом, наприклад, натрій або берилій. Елементом, який має найбільше стабільних ізотопів, є олово, у нього їх 10.
Стабільність ізотопів
Щоб ядро атома конкретного хімічного елементу було стабільним, необхідно дотримання певного співвідношення нейтронів і протонів в цьому ядрі. Якщо це співвідношення порушується, ізотоп стає нестабільним і в результаті процесів радіоактивності розпадається на більш стабільні ізотопи. Поняття стабільності є відносним, оскільки багато ізотопи, будучи нестабільними, мають великий період напіврозпаду і можуть вважатися відносно стабільними.
Нестабільні або радіоактивні ізотопи перетворюються в більш стабільні атоми. В результаті цього процесу відбувається випущення бета-, альфа – або гамма-випромінювання.
Штучно отримані радіоактивні ізотопи використовуються для різних технік дослідження в медицині. Застосування ж природних радіоактивних ізотопів знаходить себе в області геології для визначення віку порід і живих організмів, а також при виробництві атомної енергії.
Ізотопи калію
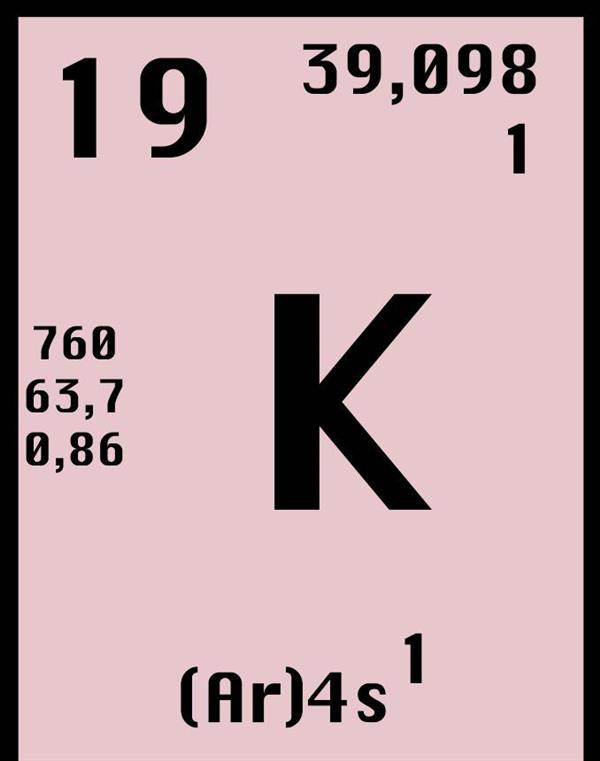
Калій має 24 різних ізотопу. Ці ізотопи мають масу від 32 до 56 в атомних одиницях маси (ємо себе). Враховуючи, що калій займає 19 порядковий номер в таблиці Менделєєва, значить, ядро ізотопу калію містить 19 протонів і від 13 до 37 нейтронів. З усіх цих ізотопів всього три володіють великим часом життя. Говорячи більш точно, зазначимо, що два ізотопи, 39K і 41 K, є стабільними, у той час як третій ізотоп, 40K, має великий період напіврозпаду (1,25 мільярда років).
Вміст в природі калію і його ізотопів
Вміст в природі ізотопів калію становить 2,4 % від маси всієї земної кори, що ставить його на 7-е місце в списку найбільш поширених елементів на нашій планеті. З-за високої хімічної активності дуже важко отримати чистий калій. Крім того, розчинність калію дуже велика, тому в багатьох мінералах він міститься в невеликих концентраціях. Тим не менше на дні давніх озер знаходяться великі кількості цього елемента у вигляді наступних мінералів:
- карналіт;
- лангбейнит;
- полигалит;
- сильвин.

З цих мінералів видобуток калію є економічно доцільною. Але калій існує в цих мінералах не у вигляді одного ізотопу. Як було вище сказано про стабільні ізотопи, калій має три ізотопи, вміст в природі яких становить 93,3 % 39K, 6,7 % 41 K і 0,012 % 40K.
Відносно стабільний ізотоп K40
Радіоактивний ізотоп калію 40K розпадається або за рахунок захоплення електрона, або за рахунок випущення позитрона. При цьому утворюється ізотоп аргону 40Ar. Великий період напіврозпаду 40K (1,248*109 років) пояснюється спін-забороненим переходом цього ізотопу в інший стабільний елемент.
У будь-якому калийсодержащем мінералі цей радіоактивний ізотоп знаходиться в достатніх кількостях для демонстрації в шкільних експериментах явища радіоактивності. У людей і тварин цей ізотоп є головним джерелом їх радіоактивності. Так, у людини вагою 70 кг в організмі знаходиться близько 4400 ядер 40K, які розпадаються щосекунди.

Радіоактивний розпад 40K на 40Ar використовується в якості одного з найбільш надійних методів визначення віку гірських порід. Суть методу калію-аргону полягає в тому, що при перетворенні гір в них не утримувався аргон. В процесі часу атоми 40K розпадалися з утворенням аргону, який затримувався в товщі гірських порід. Визначення кількості цього благородного газу, а також процентний вміст ізотопів калію дає інформацію про геологічний вік порід.
Інші радіоактивні ізотопи

За винятком зазначеного ізотопу 40K, всі інші ізотопи цього хімічного елемента мають періоди напіврозпаду менше 1 дня, більша ж частина ізотопів розпадається швидше, ніж проходить хвилина. Чому ізотопи калію, мають маси відмінні від 39-41 ОТРИМАЄМО, розпадаються так швидко? Справа в тому, що в ядрі атома калію міститься 19 протонів, а закони стабільності атомного ядра кажуть, що кількість нейтронів має бути приблизно таке ж, щоб атом міг існувати велика кількість часу, не відчуваючи радіоактивний розпад. Іншими словами, чим ближче число нейтронів у ядрі калію до 19, тим стабільніше буде такий ізотоп.
Наприклад, ізотопи 42K і 43ДО (число нейтронів 23 і 24) мають періоди напіврозпаду 12,3 години і 22,3 години, відповідно. У той же час ізотопи 33K і 34K (число нейтронів 14 і 15) розпадаються за кілька наносекунд.

