Термін “підстава” зустрічається дуже часто в процесі вивчення хімії, притому як органічної, так і неорганічної. Вчені вперше задалися питанням: «Що таке «основа» в хімії?» ще в XVII столітті. Результатом стало виникнення декількох теорій кислот і підстав, що носять імена їхніх засновників. Визначення, що таке «підставу» хімії, можна дати, звернувшись до тієї, яка пропонує найкращий обґрунтування для даного випадку.
Теорії кислот і основ
В рамках даної статті будуть розглянуті лише частини їх, відповідають на питання: «Що таке «основа» в хімії?»
Найбільш відомих теорій зараз чотири.
1. Теорія електролітичної дисоціації Арреніуса-Оствальда.
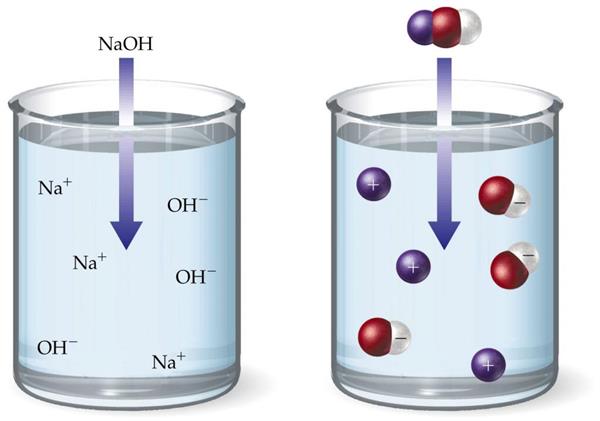
Заснована на уявленнях про розпад речовин на іони у водному середовищі. Згідно цієї теорії, підставами є речовини, які при дисоціації утворюють гідроксид-аніон.
Перевагою її є можливість класифікації кислот і підстав по силі. Недолік же полягає в застосовності тільки для водних розчинів і неможливості пояснення основних властивостей речовин, що не містять гідроксильних груп.
2. Протолитическая теорії Бренстеда-Лоурі.
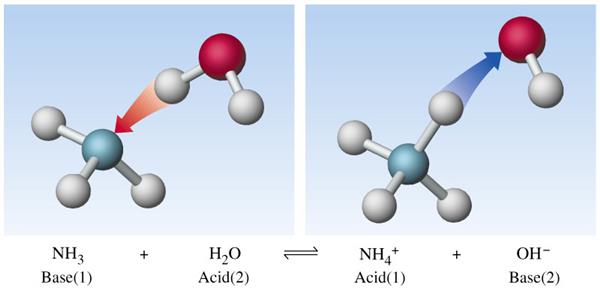
У даному випадку підставою вважається речовина, здатна приєднувати протон (катіон водню). При цьому з’являється поняття амфотерності – можливості наявності у сполук або кислотних, або основних властивостей залежно від умов. В ній окремо не розглядаються основні і кислотні властивості. Основне положення теорії – речовина стає тим або іншим в присутності іншого з’єднання в залежності від їх природи. Стверджується, що кислоти і підстави обов’язково існують у вигляді пар сполук.
Ця теорія є більш загальною, пояснює основні властивості сполук, що не мають у молекулі гідроксильних груп, а також дозволяє зрозуміти, що таке «основа» в органічній хімії. Саме за допомогою теорії Бренстеда-Лоурі вдалося пояснити механізм дії кислотно-основних індикаторів.

3. Електронна теорія Льюїса.
Є ще більш розширеною. Вона пояснює механізм міграції протона, описаний у попередній теорії. Льюїс стверджував, що основа – це таке з’єднання, яке може виступати донором вільної електронної пари. Прикладом підстав Льюїса в хімії є вода, аміак. Основність органічних сполук також здебільшого пояснюється теорією.
4. Узагальнена теорія Усановича.
У ній прийнято оперувати зарядами частинок. Так, згідно Усановичу, підстава – це частинка, яка може приєднувати протон або інші катіони, або віддавати електрон і інші аніони. На жаль, вона не описує неіоногенні процеси. Теорія Усановича не була доопрацьована. Донині вченими робляться спроби довести її до логічного завершення. Очікується, що в цьому разі саме теорія Усановича стане найбільш точно і правильно описує природу кислотно-основних властивостей сполук.
В даний час використовуються всі чотири теорії залежно від розглянутих систем.
Що таке «основа» в неорганічної хімії?

На це питання найпростіше відповісти за допомогою електронної теорії або теорії Арреніуса-Оствальда, так як більшість реакцій відбуваються у водних розчинах.
Що таке «підстава»? Приклади в неорганічної хімії: гідроксиди металів, аміак.
У першому випадку у водних розчинах молекули дисоціюють з відщепленням гідроксид-аніони. Це яскравий приклад того, що таке «підстава» з точки зору теорії Арреніуса.
Основні властивості аміаку ж краще пояснюються наявністю неподіленої електронної пари на атомі азоту, що відповідає теорії Льюїса.
В органічній хімії
Що таке підстави в хімії? Приклади органічних підстав – представники класу амінів. Основність органічних сполук прийнято пояснювати з точки зору теорії Льюїса. Подібно аміаку, основні властивості амінів обумовлені неподіленої електронної парою, що знаходиться на атомі азоту.
Ще один приклад підстави в органічній хімії – аніони карбонових кислот і алкоксильні (виходять при отщеплении атома водню від спиртової групи). Ці властивості можна пояснити за допомогою теорії Усановича або Бренстеда-Лоурі.
Висновок
Отже, що ж таке «основа» в хімії? Це речовина, здатна приєднувати до себе катіони водню або інших елементів. Тобто, теоретично, це може бути будь-аніон або молекула, що має на валентних осях щонайменше одного з атомів неподеленную електронну пару.
Підстави прийнято класифікувати за природою (органічні і неорганічні), силі, кислотності (кількістю катіонів водню, які можуть бути приєднані до однієї молекулі підстави). Вони мають величезне значення у житті людини. А тому спроби зрозуміти природу їх властивостей ще більш глибоко і повно, ймовірно, будуть робитися ще протягом довгого часу.

