Одна з задач хімії – це вивчення будови речовини, в тому числі з’ясування механізму утворення різних сполук з простих речовин, утворених атомами одного хімічного елемента. Особливості взаємодії атомів, точніше, їх різнойменно заряджених компонентів – електронних оболонок і ядер, описуються як різні типи хімічного зв’язку. Так, речовини, що мають молекулярну будову, утворюються за допомогою ковалентного зв’язку, для опису якої в 1931 році американським хіміком Л. Полінгом була запропонована модель гібридизації атомних орбіталей.
Поняття про ковалентного зв’язку
У тих випадках, коли в процесі взаємодії відбувається утворення спільної для двох атомів пари валентних електронних хмар, говорять про ковалентного зв’язку. В результаті її виникнення формується найменша частинка простої або складної речовини – молекула.

Однією з особливостей ковалентного зв’язку є її спрямованість – наслідок складної форми електронних орбіталей p, d і f, які, не володіючи сферичної симетрією, мають певну просторову орієнтацію. Ще одна важлива особливість даного типу хімічного зв’язку – насичуваність, обумовлена обмеженою кількістю зовнішніх валентних – хмар в атомі. Саме тому існування молекули, наприклад, H2O, можливо, а H5O – ні.
Типи ковалентного зв’язку
Утворення спільних електронних пар може відбуватися різними способами. У механізмі утворення ковалентного зв’язку важливу роль відіграє характер перекриття хмар і просторова симетрія результуючого хмари. За даним критерієм Л. Полінг запропонував розрізняти наступні типи:
- Сигма-зв’язок (σ) відрізняється найбільшою ступенем перекриття по осі, що проходить через атомні ядра. Тут щільність хмари буде максимальною.
- Пі-зв’язок (π) утворюється при бічному перекриванні, і електронне хмара, відповідно, має найбільшу щільність поза з’єднує ядра осі.
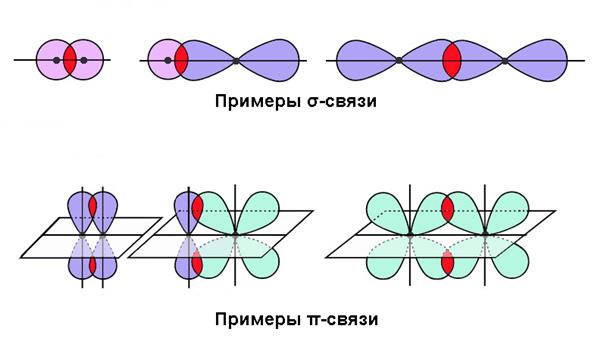
Ці просторові характеристики мають велике значення остільки, оскільки вони корелюють з енергетичними параметрами ковалентного зв’язку.
Особливості багатоатомних молекул
Концепція гібридизації атомних орбіталей була введена Полінгом для пояснення однією з особливостей ковалентних зв’язків у багатоатомних молекулах. Відомо, що зв’язки, утворені центральним атомом у таких молекулах, виявляються однаковими за просторовим і енергетичних характеристик. Це відбувається незалежно від того, які орбіталі (s, p або d) беруть участь у формуванні спільної електронної пари.
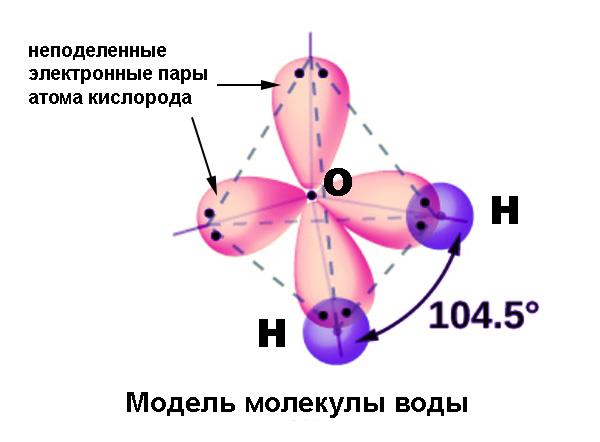
Дуже зручним і наочним прикладом для ілюстрації цього явища служить атом вуглецю. При вступі в хімічну зв’язок атом у збудженому стані має 4 валентних орбіталі: 2s, 2px, 2py і 2pz. Три останні відрізняються від орбіталі 2s по енергії і формі. Тим не менш в молекулі, наприклад, метану CH4 всі чотири зв’язку абсолютно рівноцінні і мають валентні кути 109,5° (в той час як p-орбіталі розташовані під кутами 90°). В інших з’єднаннях вуглецю зустрічаються валентні кути 120° і 180°; у молекулах, що містять азот (аміак NH3) і кисень (вода H2O) ці кути складають 107,5° і 104,5°. Виникнення подібних валентних кутів також вимагало пояснення.
Суть явища
Ідея гібридизації полягає в утворенні усереднених орбіталей шляхом перекривання електронних хмар різного типу з близькими значеннями енергії – s, p, іноді d. Кількість результуючих – гібридних – орбіталей відповідає числу перекриваються хмар. Оскільки орбіталь – це хвильова функція, що визначає ймовірність знаходження електрона в тій чи іншій точці атома, гібридна орбіталь представляє собою накладення хвильових функцій, що відбувається в результаті електронних переходів при збудженні атома. Воно призводить до виникнення рівнозначних хвильових функцій, що розрізняються тільки спрямованістю.
Гібридні орбіталі еквівалентні по енергії і мають однакову форму у вигляді об’ємної вісімки, що має сильну асиметрію відносно ядра. На гібридизацію витрачається менше енергії, що виділяється при утворенні міцної ковалентного зв’язку з гібридними орбіталей, тому такий процес енергетично вигідний, тобто найбільш вірогідний.
Основні види гібридизації орбіталей і геометрія молекул
Можливі різні варіанти перекривання (змішування) зовнішніх електронних хмар в атомі. Найпоширенішими є наступні види накладення орбіталей:
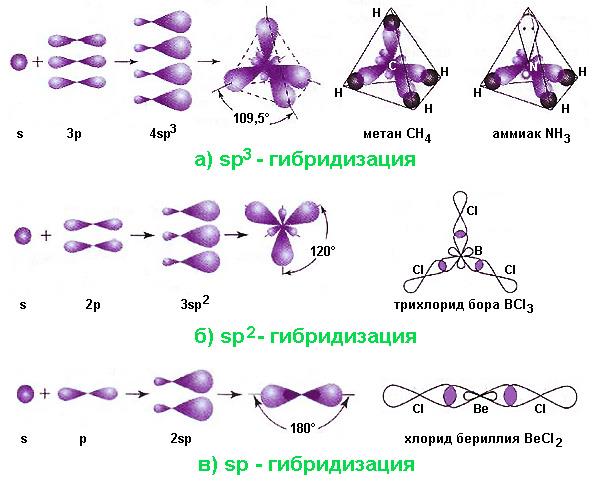
- Sp3-гібридизація. Цей варіант реалізується при накладанні однієї s – і три p-орбіталей. Результатом його стають чотири гібридні орбіталі, осі яких спрямовані для будь-якої пари під кутами 109,5°, відповідним мінімального взаємного відштовхування електронів. При вступі цих орбіталей у σ-зв’язки з іншими атомами, формується молекула тетраэдрической конфігурації, наприклад, метан, етан C2H6 (комбінація двох тетраедрів), аміак, вода. В молекулі аміаку одна, а в молекулі води – дві з вершин тетраедра зайняті неподеленными електронними парами, що призводить до зменшення валентного кута.
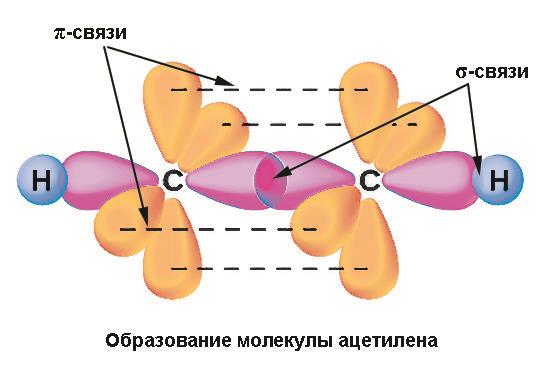
- Sp2-гібридизація виникає при комбінації однієї s – і двох p-орбіталей. У цьому випадку трійка гібридних орбіталей розташовується під кутами 120° в одній площині. Подібну трикутну форму мають, наприклад, молекули трихлорида бору BCl3, знаходить застосування в різних технологіях. Інший приклад – молекула етилену – формується за рахунок додаткової π-зв’язку між атомами вуглецю, в яких по одній p-орбіталі негибридные і орієнтовані перпендикулярно площині, утвореної двома трикутниками.
- Sp-гібридизація відбувається, коли змішуються одна s – і одна p-орбіталь. Два гібридних хмари розташовуються під кутом 180°, а молекула має лінійну конфігурацію. Прикладами можуть служити молекули хлориду берилію BeCl2 або ацетилену C2H2 (в останній дві негибридные p-орбіталі вуглецю утворюють додаткові π-зв’язку).
Існують і більш складні варіанти гібридизації атомних орбіталей: sp3d, sp3d2 та інші.
Роль моделі гібридизації
Концепція Полінга дає хороше якісне опис будови молекул. Вона зручна і наочна, успішно пояснює деякі особливості ковалентних сполук, такі як величина валентних кутів або вирівнювання довжини хімічного зв’язку. Однак кількісна сторона моделі не може вважатися задовільною, оскільки не дозволяє робити багато важливих передбачення, що стосуються фізичних ефектів, пов’язаних з особливостями будови молекул, – наприклад, молекулярних фотоэлектронных спектрів. Сам автор концепції гібридизації вже на початку 1950-х років відзначав її недоліки.
Тим не менш у становленні сучасних уявлень про будову речовини модель гібридизації атомних орбіталей зіграла велику роль. На її основі були розроблені більш адекватні концепції, наприклад, теорія відштовхування електронних пар. Тому, безумовно, модель гібридизації з’явилася важливим етапом в розвитку теоретичної хімії, а при описі деяких аспектів електронної структури молекул вона цілком застосовна і в даний час.

