Об’єм і тиск ідеального газу
Рівняння, основне в МКТ (молекулярно-кінетичної теорії), говорить, що добуток тиску на об’єм – це константа, якщо кількість речовини і температура газу не змінюються. Звідси отримуємо приватний випадок основного рівняння стану – Бойля-Маріотта закон: P1V1 = P2V2, тобто, при будь-якому ізотермічному процесі ідеального газу тиск займаному обсягу обернено пропорційно.
Закони Гей-Люссака і температура газу
Основне рівняння МКТ дозволяє також встановити зв’язок температури та об’єму під час изобарного процесу, тобто, який відбувається з постійним тиском. В цьому випадку виходить вираз V1/T1 = V2/T2. Це вираз прийнято називати першим законом Гей-Люссака.
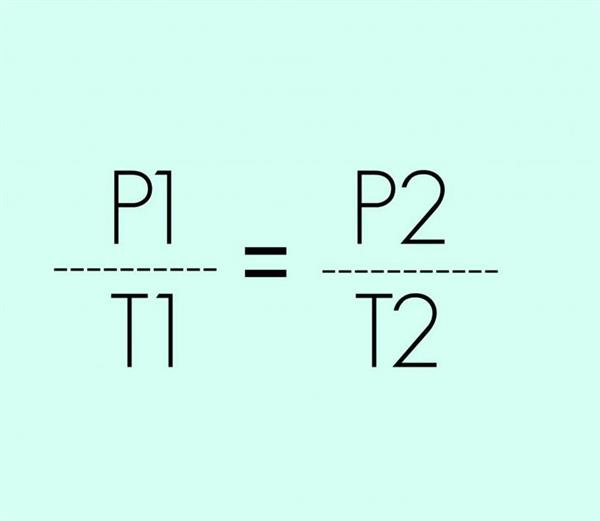
Тепер, якщо покласти, що обсяг залишається величиною постійною для ідеального газу, з основного рівняння МКТ отримаємо P1/T1 = P2/T2, такий процес називається изохорным, а вираз носить назву другого закону Гей-Люссака.
В обох законах Гей-Люссака абсолютна температура газу знаходиться у прямій пропорційності до обсягу або тиску.