Статистика та МКТ
Макроскопічні параметри, які спостерігаються експериментально, наприклад, тиск і температура, є усередненими величинами по всіх молекул газу, тому для їх опису необхідно використовувати статистичний аналіз.
Спостерігається тиск є результатом ударів мільйонів і мільярдів об стінки посудини молекул газу. При цьому результуюча сила виявляється спрямованої перпендикулярно до стінки, оскільки всі інші сили в інших напрямках компенсують один одного.
Температура є мірою середньої кінетичної енергії часток газу. Зазначимо, що середнє значення швидкості руху частинок в газі вище такої в рідині.
Статистичні подання МКТ дозволяють розрахувати кількість часток, що складають газ при заданих умовах, тобто, при відомих: тиску, температури і обсязі.
Рівняння стану ідеального газу
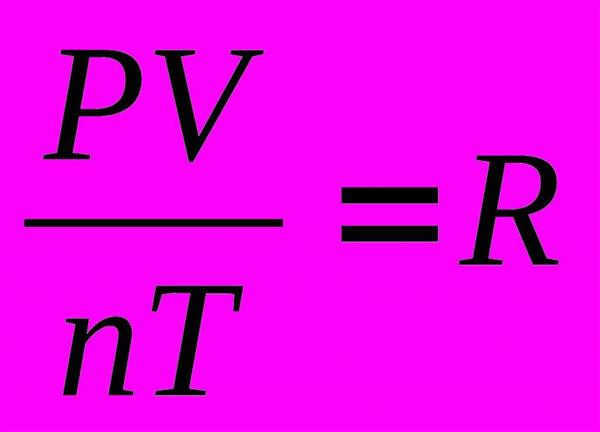
Якщо застосувати постулати МКТ для ідеального газу, то можна отримати наступне вираз: PV = nRT, де V, P, T, n, R – об’єм, тиск, температура газу, кількість речовини та універсальна газова постійна, відповідно. Даний вираз носить назву основного рівняння для ідеальних газів в теорії молекулярно-кінетичної. Кількість речовини n виражається в спеціальних одиницях – моль. Один моль – це такий параметр, який містить 6,023*1023 частинок, дана величина – це число Авогадро, яке названо в честь знаменитого італійського вченого. Універсальна постійна газу дорівнює добутку постійної Больцмана і числа Авогадро, тобто R = 6,023*1023*1,38*10-23=8,31 Дж/(моль*К).