Формула метиламіну в хімії вважається майже примітивною. Однак для простих смертних одна назва цього з’єднання є загрозливим, не кажучи про те, що про структуру або формулою і зовсім нічого не відомо. Багатьом невідомо про специфічний запах даного з’єднання або про його надзвичайно широкі можливості застосування в різних виробництвах. Це цілком очевидно, адже все знати неможливо, і це факт. Але хіба не цікаво відкривати для себе щось раніше невідоме?
Що таке метиламин?
Метиламин – органічна сполука з формулою CH3NH2. Він є одним з похідних аміаку, належить до аліфатичних органічних речовин. Його відносять до вкрай вогненебезпечним сполук, так як цей газ легко змішується з повітрям, утворюючи при цьому вибухові суміші. Структура даної речовини представлена на малюнку нижче.
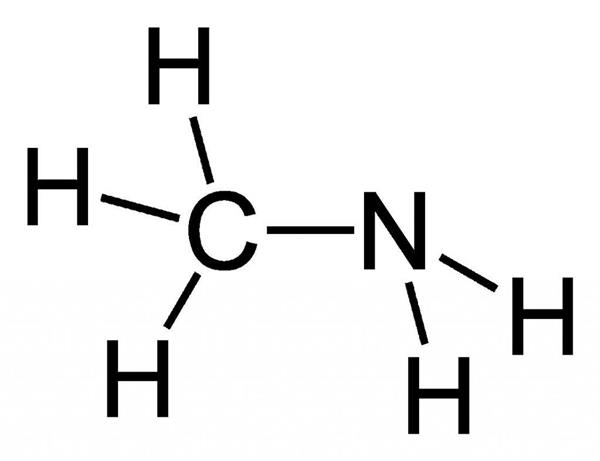
З назви очевидно, що дана речовина відноситься до такого класу органічних сполук, як аміни (а саме – первинні аміни), і воно є найпростішим його представником.
При нормальних умовах метиламин – це газ (як і згадувалося раніше), без кольору, але з яскраво вираженим запахом аміаку.
Інгаляція даними речовиною загрожує сильним подразненням шкіри, очей, верхніх дихальних шляхів. Здатен чинити негативний вплив на нирки і печінку організму. А вдихання його веде до порушення і подальшого пригнічення центральної нервової системи. Можливе настання смерті внаслідок зупинки дихання.
Способи синтезу метиламіну
Один з промислових способів отримання метиламіну спирається на реакцію метанолу з аміаком. Умовами проведення даного хімічного взаємодії є висока температура (370-430 °С), а також тиск 20-30 бар.
Реакція здійснюється в газовій фазі, але на гетерогенном каталізаторі, заснованому на цеоліті.
В суміші з метиламином утворюються побічні речовини, такі як диметиламин і триметиламін. Тому даний спосіб одержання потребує очищення метиламіну (наприклад, шляхом неодноразового перегонки).
Інший спосіб отримання метиламіну полягає в проведенні реакції формаліну з хлоридом амонію при нагріванні. Але і це не останній можливий варіант синтезу даного аміна!
Також відомий спосіб отримання метиламіну за допомогою перегрупування ацетаміду по Гофману. На малюнку нижче представлено рівняння даної реакції.
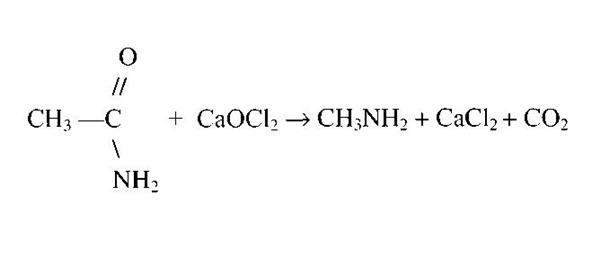
Хімічні властивості метиламіну
Як правильно знайомитися з новим хімічним з’єднанням? Для початку потрібно дізнатися, як його назва, особливості структури. Потім важливо зрозуміти, як його можна отримати, тому спочатку було розказано про методи отримання метиламіну. А тепер потрібно вивчити його хімічні властивості.
Даним органічному поєднанню властиві всі типові властивості первинних амінів, так як воно є стандартним представником даного класу.
Горіння метиламіну відповідає рівнянню: 4CH3NH2+9O2=4CO2+10H2O+2N2
Якщо в якості речовини, що вступає в реакцію з метиламином, виступає вода або мінеральна кислота, то відбувається освіту, відповідно, гідроксиду метиламмония або кристалічної солі.
Дані реакції представлені на малюнку нижче.
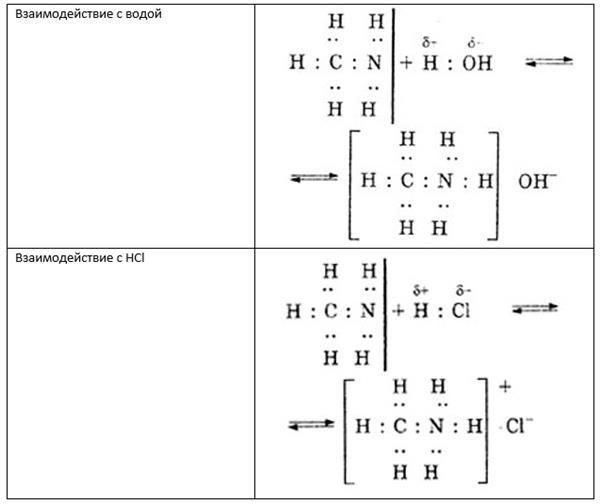
Якщо проводити порівняння метиламіну з аніліном або аміаком, то можна прийти до висновку, що метиламин проявляє більш сильні основні властивості. Це пояснюється тим, що атом азоту в складі молекул метиламіну більш электроотрицателен.
Якщо в якості речовини, що вступає в реакцію з метиламином, виступає NaOCl, то відбувається хлорування – заміщення атома водню аміногрупи на атом хлору. Так само як і інші первинні аміни, метиламин утворює спирт при взаємодії з азотистої кислоти (HNO2).
Застосування метиламіну і умови зберігання
CH3NH2 має дуже широку область застосування. Він використовується для синтезу барвників, фармацевтичних препаратів (наприклад, неофиллина, теофіліну, промедолу), пестицидів, гербіцидів, інсектицидів (севін, шрадан), фунгіцидів, стерилізаторів землі в сільській промисловості, а також застосовується у ветеринарній медицині.

Використовується метиламин і при виготовленні сильних вибухонебезпечних речовин (таких як, наприклад, тетрил), різних матеріалів для фото (метолів), розчинників (наприклад, ДМФА, диметилацетамид), прискорювачів вулканізації, інгібіторів корозії, дубильних речовин, ракетних палив (N,N-диметилгідразин).
Також зустрічається метиламин в природі як другорядний экскрет у кісткових риб.
Найчастіше використовують дане з’єднання у вигляді 40-процентного розчину у воді, метанолі, етанолі або тетрагідрофурані.
Щоб застосовувати метиламин у виробництві або в процесі виготовлення чого-небудь, необхідно правильно його зберігати.
Оптимальні умови зберігання: в зрідженому вигляді в обсязі 10-250 м3, в циліндричних резервуарах, розташованих горизонтально, при кімнатній температурі, але далеко від сонячних променів, у місцях, недоступних для дітей і тварин.
Зрозуміло, при роботі з метиламином, як і з будь-яким іншим хімічним речовиною, необхідно використовувати спеціальний одяг, рукавички та окуляри для індивідуального захисту. Особливу увагу потрібно приділити захисту слизових оболонок і органів дихання.

