Трифторид хлору – з’єднання, яке характеризується дуже сильною хімічною активністю. Під його впливом відбувається окислення практично всіх речовин, включаючи скло. Трифторид хлору токсичний і має руйнівний вплив на живі організми. Одним з цікавих фактів, пов’язаних з цим з’єднанням, є те, що у фашистській Німеччині його планували використовувати як зброю. В США в 1943 р. робилися також спроби його застосування в якості палива для швидкохідних підводних човнів, але вони закінчилися невдачею.
Опис
Трифторид хлору, формула якого ClF3, – безбарвний газ із сильним запахом. При його попаданні на органічні та неорганічні речовини у багатьох випадках відбувається їх самозаймання (навіть тих, які відрізняються вогнестійкістю, наприклад азбест), так як він є сильним окислювачем. У зв’язку з цим тривалий час було ускладнено отримання ClF3 і його зберігання.
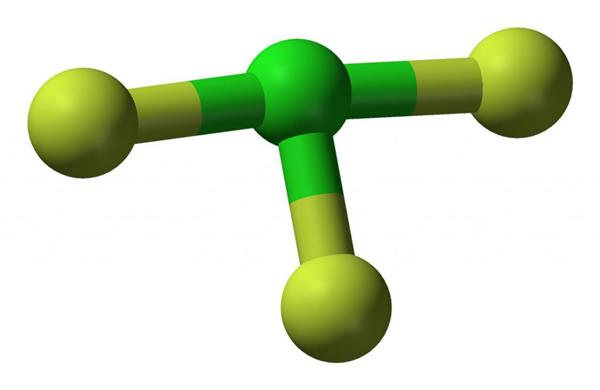
Газ можна сконденсувати і тримати тривалий час в спеціальних балонах. Конденсування відбувається при температурі 285 °До або при підвищенні тиску. В такому стані це речовина виглядає як рідина зеленуватого кольору. У статті наведено фото трифториду хлору, що відображає його структуру. Вивчення інфрачервоного спектра поглинання дозволило зробити висновок про те, що дане з’єднання має Т-образну структуру молекул.
Фізико-хімічні властивості
Основними характеристиками трифториду хлору є:
- температура плавлення – 196 °К;
- температура кипіння – 284 °К;
- молекулярний вага при нормальний умовах – 92,457 г/моль;
- електропровідність при 25 °С – 3,1×10-9 Ом-1∙см-1;
- вміст фтору – 61 %;
- щільність при 25 °С – 1,8 г/см3.
Ця речовина є найбільш реакционноспособным з усіх галогенофторидов і сильним окислювачем. Може бурхливо реагувати навіть з водою. З деякими сполуками реакція взаємодії протікає з вибухом.

ClF3 в газоподібному стані при його опроміненні позитивно зарядженими альфа-частинками розкладається. Продуктами розпаду є монофторид хлору і фтору.
Реагування з органічними речовинами відбувається з самозайманням, тому їх фторування практично не піддається контролю.
Отримання
Вперше це з’єднання було синтезовано в 1930 р. Очищені фтор і хлор подавалися в нагрітий реактор з міді. В ньому відбувалося утворення моно – і трифториду хлору, який конденсувалася в першому приймачі при -70 °С, у другому приймачі вчувався ClF (при t= -150 °С), а в третьому був рідкий повітря для виморожування надлишку фтору. До останнього приймача приєднувалася трубка, заповнена прожареним KF, який служив для захисту від атмосферної вологи.

Так як ця речовина дуже активно в хімічному відношенні, то при його синтезі можна застосовувати апаратуру, зроблену з міді (стійка до температури 400 °С), нікелю (до 750 °С) і їх сплавів (монель). Це пояснюється утворенням захисної фторидной плівки на їх поверхні. У лабораторних умовах використовують посуд із фторопласта або монель-металу, так як дана сполука здатна запалювати скло.
Застосування
Трифторид хлору здатен взаємодіяти з усіма елементами, крім платини, кисню та азоту. Тому дана речовина розглядається, насамперед, як фторирующего агента для виробництва різних сполук, що містять фтор.
Суміш пентаборана і трифториду хлору становить певний інтерес для застосування в якості ракетного палива. У часи Другої світової війни нацистські вчені проводили дослідження, вивчаючи можливість використання цієї речовини в якості дешевого хімічної зброї та сировини для вогнеметів і бомб. Ними було виготовлено близько 30 т трифториду хлору, але його не використовували. В даний час дане з’єднання підпадає під дію Конвенції про заборону хімічної зброї.

За кордоном трифторид хлору використовують також для підвищення температури полум’я при зварюванні і різанні металів (в якості добавки до зварювального газу). Проводяться дослідження щодо можливості застосування ClF3 для регенерації ядерного пального.
У зв’язку з труднощами здійснення експериментальних робіт дане речовина ще недостатньо вивчене, особливо це стосується його хімічних властивостей. Фторидсодержащие матеріали в даний час знаходять широке застосування в якості флюсів при виплавці сталі, зварювання, пайку, а також в електроніці та лазерній техніці.
Вплив на організм людини
Трифторид хлору – це дуже токсичне з’єднання. Крім опіків, які воно викликає через свою підвищену окислювальної здатності, ClF3 надає задушливу дію і вражає легені.
У процесі реагування з навколишнім середовищем трифторид хлору утворює пари плавикової кислоти, які призводять до гострих та хронічних отруєнь. Кислота відноситься до 2-го класу небезпеки, як і вихідна речовина. Максимальна ГДК трифториду хлору в повітрі – 0,4 мг/м3. Спроби нейтралізації полум’я водою викликають вибухову реакцію.

