Типи ковалентного зв’язку
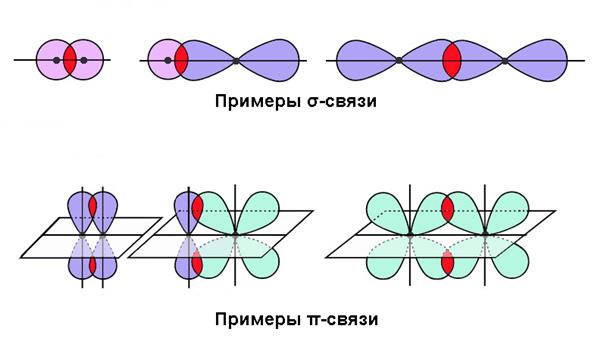
Утворення спільних електронних пар може відбуватися різними способами. У механізмі утворення ковалентного зв’язку важливу роль відіграє характер перекриття хмар і просторова симетрія результуючого хмари. За даним критерієм Л. Полінг запропонував розрізняти наступні типи:
- Сигма-зв’язок (σ) відрізняється найбільшою ступенем перекриття по осі, що проходить через атомні ядра. Тут щільність хмари буде максимальною.
- Пі-зв’язок (π) утворюється при бічному перекриванні, і електронне хмара, відповідно, має найбільшу щільність поза з’єднує ядра осі.
Ці просторові характеристики мають велике значення остільки, оскільки вони корелюють з енергетичними параметрами ковалентного зв’язку.
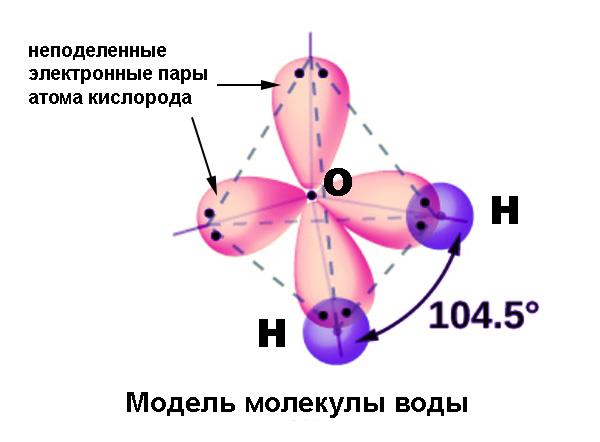
Особливості багатоатомних молекул
Концепція гібридизації атомних орбіталей була введена Полінгом для пояснення однією з особливостей ковалентних зв’язків у багатоатомних молекулах. Відомо, що зв’язки, утворені центральним атомом у таких молекулах, виявляються однаковими за просторовим і енергетичних характеристик. Це відбувається незалежно від того, які орбіталі (s, p або d) беруть участь у формуванні спільної електронної пари.
Дуже зручним і наочним прикладом для ілюстрації цього явища служить атом вуглецю. При вступі в хімічну зв’язок атом у збудженому стані має 4 валентних орбіталі: 2s, 2px, 2py і 2pz. Три останні відрізняються від орбіталі 2s по енергії і формі. Тим не менш в молекулі, наприклад, метану CH4 всі чотири зв’язку абсолютно рівноцінні і мають валентні кути 109,5° (в той час як p-орбіталі розташовані під кутами 90°). В інших з’єднаннях вуглецю зустрічаються валентні кути 120° і 180°; у молекулах, що містять азот (аміак NH3) і кисень (вода H2O) ці кути складають 107,5° і 104,5°. Виникнення подібних валентних кутів також вимагало пояснення.