Основні види гібридизації орбіталей і геометрія молекул
Можливі різні варіанти перекривання (змішування) зовнішніх електронних хмар в атомі. Найпоширенішими є наступні види накладення орбіталей:
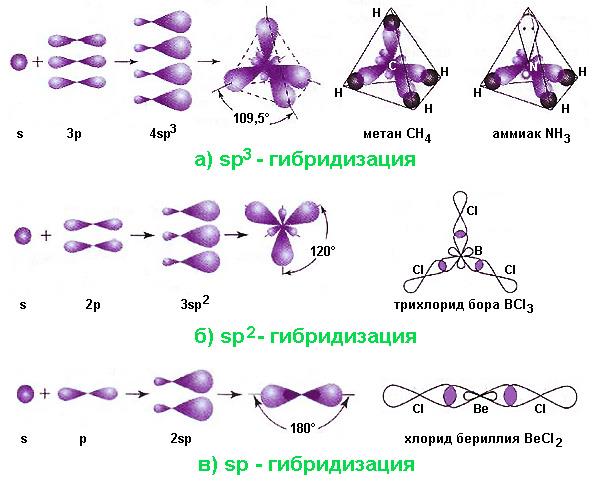
- Sp3-гібридизація. Цей варіант реалізується при накладанні однієї s – і три p-орбіталей. Результатом його стають чотири гібридні орбіталі, осі яких спрямовані для будь-якої пари під кутами 109,5°, відповідним мінімального взаємного відштовхування електронів. При вступі цих орбіталей у σ-зв’язки з іншими атомами, формується молекула тетраэдрической конфігурації, наприклад, метан, етан C2H6 (комбінація двох тетраедрів), аміак, вода. В молекулі аміаку одна, а в молекулі води – дві з вершин тетраедра зайняті неподеленными електронними парами, що призводить до зменшення валентного кута.
- Sp2-гібридизація виникає при комбінації однієї s – і двох p-орбіталей. У цьому випадку трійка гібридних орбіталей розташовується під кутами 120° в одній площині. Подібну трикутну форму мають, наприклад, молекули трихлорида бору BCl3, знаходить застосування в різних технологіях. Інший приклад – молекула етилену – формується за рахунок додаткової π-зв’язку між атомами вуглецю, в яких по одній p-орбіталі негибридные і орієнтовані перпендикулярно площині, утвореної двома трикутниками.
- Sp-гібридизація відбувається, коли змішуються одна s – і одна p-орбіталь. Два гібридних хмари розташовуються під кутом 180°, а молекула має лінійну конфігурацію. Прикладами можуть служити молекули хлориду берилію BeCl2 або ацетилену C2H2 (в останній дві негибридные p-орбіталі вуглецю утворюють додаткові π-зв’язку).
Існують і більш складні варіанти гібридизації атомних орбіталей: sp3d, sp3d2 та інші.

