Іонна зв’язок
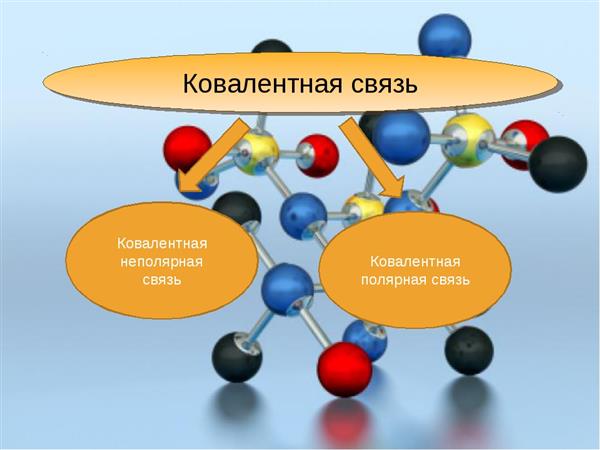
Чим відрізняється ковалентний та іонний хімічна зв’язок? Якщо ковалентний зв’язок характерна для неметалів, то іонна зв’язок утворюється між атомами, що мають істотні відмінності щодо електронегативності. Наприклад, це характерно для з’єднань елементів першої і другої груп головних підгруп ПС (лужних і лужноземельних металів) і елементів 6 і 7 груп головних підгруп таблиці Менделєєва (халькогенов і галогенів).
Вона формується в результаті електростатичного притягання іонів, що володіють протилежними зарядами.
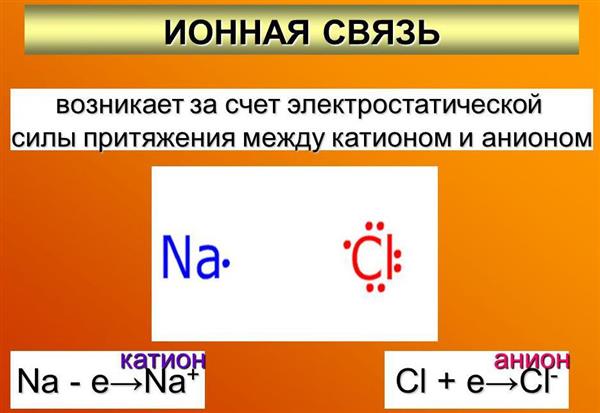
Особливості іонного зв’язку
Так як силові поля протилежно заряджених іонів розподіляються рівномірно в усіх напрямках, кожен з них здатний притягувати до себе протилежні по знаку частки. Це і характеризує ненаправленість іонного зв’язку.
Взаємодія двох іонів, що володіють протилежними знаками, не передбачає повної взаємної компенсації індивідуальних силових полів. Це сприяє збереженню здатності притягувати за іншими напрямами іони, отже, спостерігається ненасиченість іонного зв’язку.
В іонному з’єднанні в кожного іона є можливість притягувати до себе певне число інших, що володіють протилежних знаком, щоб сформувати кристалічну решітку іонного характеру. В такому кристалі не існує молекул. Кожен іон оточується в речовині якимсь конкретним числом іонів іншого знака.