Квантованность енергетичних рівнів
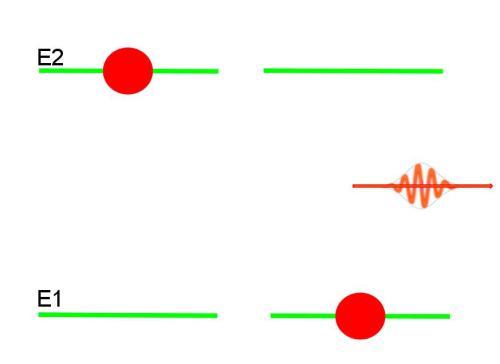
Стаціонарні орбіти електрона в атомі, про яких вперше заговорив Бор, є стабільними квантовими станами цієї частки-хвилі. Ці стани характеризуються певною енергією. Останнє означає, що електрон в атомі знаходиться в деякій енергетичної “ямі”. Потрапити в іншу “яму” він може, якщо отримає додаткову енергію ззовні у вигляді фотона.
У лінійчатих спектрів поглинання і флуоресценції для водню, формули яких наведено вище, можна побачити, що перший член в дужках являє собою деяке число виду 1/m2, де m=1, 2, 3.. – ціле число. Воно відображає номер стаціонарної орбіти, на яку переходить електрон з більш високого енергетичного рівня n.
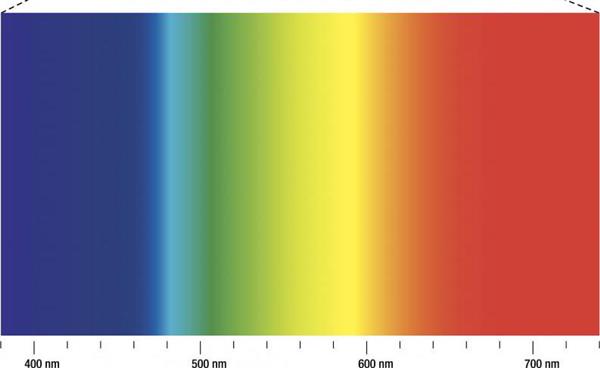
Як вивчають спектри у видимому діапазоні?

Вище вже було сказано, що для цього використовують скляні призми. Вперше це зробив Ісаак Ньютон в 1666 році, коли розклав видиме світло на набір кольорів веселки. Причина, по якій спостерігається цей ефект, що полягає в залежності коефіцієнта заломлення від довжини хвилі. Так, синій колір (короткі хвилі) переломлюється сильніше, ніж червоний (довгі хвилі).
Відзначимо, що в загальному випадку при русі пучка електромагнітних хвиль в якій-небудь матеріальній середовищі високочастотні складові цього пучка завжди переломлюються і розсіюються сильніше, ніж низькочастотні. Яскравим прикладом є блакитний колір неба.