Довгий час будова атома було дискусійною темою серед фізиків, поки не з’явилася створена датським вченим Нільсом Бором модель. Він не був першим, хто спробував описати рух субатомних частинок, але саме його напрацювання дозволили створити несуперечливу теорію з можливістю прогнозування місцезнаходження елементарний частинки в той чи інший момент часу.
Життєвий шлях
Нільс Бор народився 7 жовтня 1885 року в Копенгагені і помер там же 18 листопада 1962 року. Він вважається одним з найвидатніших фізиків і не дивно: саме йому вдалося побудувати несуперечливу модель воднеподібних атомів. За легендою, він побачив уві сні, як навколо якогось світиться розрідженого центру оберталося щось на зразок планет. Потім ця система різко зменшилася до мікроскопічних розмірів.
З тих пір Бор наполегливо шукав спосіб втілити сон у формулах і таблицях. Ретельно вивчаючи сучасну літературу з фізики, експериментуючи в лабораторії і розмірковуючи, він зміг досягти своєї мети. Оприлюднити результати йому не завадила навіть вроджена сором’язливість: він соромився виступати перед великою аудиторією, починав плутатися, і слухачі нічого не розуміли з пояснень вченого.
Попередники
До Бору вчені намагалися створити модель атома, засновану на постулатах класичної фізики. Найбільш успішна спроба належала Ернеста Резерфорду. В результаті численних дослідів він дійшов висновку про існування масивного атомного ядра, навколо якого рухаються по орбітах електрони. Оскільки графічно така модель була схожа на будову Сонячної системи, за нею закріпилась назва планетарної.

Але в ній був істотний недолік: атом, що відповідає резерфордовским рівнянь, виявився нестабільним. Рано чи пізно електрони, що рухалися з прискоренням по орбітах навколо ядра, повинні були впасти на ядро, а їх енергія витрачалася на електромагнітне випромінювання. Для Бору модель Резерфорда стала відправним пунктом у побудові власної теорії.
Перший постулат Бора
Головним нововведенням Бору стала відмова від використання класичної ньютонівської фізики в побудові теорії атома. Вивчивши отримані в лабораторії дані, він прийшов до висновку, що у світі елементарних частинок не працює такий важливий закон електродинаміки, як равноускоренное рух без хвильового випромінювання.
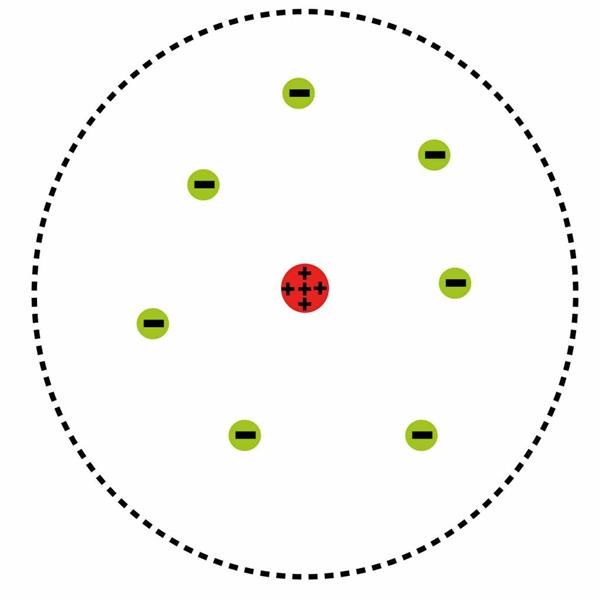
Підсумком його роздумів став закон, який звучить так: атомна система стабільна, тільки якщо вона знаходиться в одному з можливих стаціонарних (квантових) станах, кожному з яких відповідає певна енергія. Сенс цього закону, інакше званого постулатом квантових станів, що складається у визнанні відсутність електромагнітного випромінювання, що коли атом знаходиться в такому стані. Також наслідком першого постулату є визнання наявності енергетичних рівнів в атомі.
Правило частот
Однак було очевидно, що атом не може весь час перебувати в одному і тому самому квантовому стані, оскільки стабільність заперечує будь-яка взаємодія, а значить, не було б ні Всесвіту, ні руху в ній. Позірна протиріччя дозволив другий постулат моделі будови атома Бора, відомий як правило частот. Атом здатний перейти з одного квантового стану в інший з відповідною зміною енергії, випромінюючи або поглинаючи при цьому квант, енергія якого дорівнює різниці енергій стаціонарних станів.
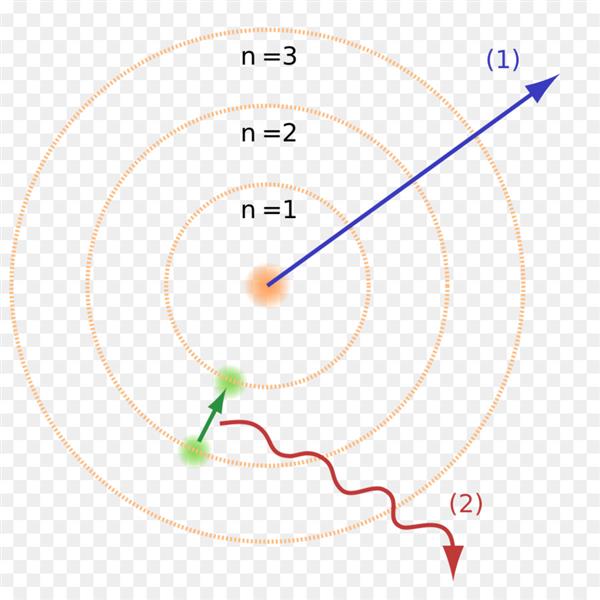
Другий постулат теж суперечить класичній електродинаміці. Згідно теорії Максвелла, характер руху електрона не може впливати на частоту його випромінювання.
Спектр атома
Квантова модель Бора стала можливою завдяки ретельному вивченню спектра атома. Довгий час вчених бентежило, що замість очікуваної безперервної колірної області, одержуваної при вивченні спектрів небесних світил, спектрограма атома була переривчастою. Лінії яскравого кольору не переходили один в одного, а поділялися значними темними ділянками.

Теорія переходу електрона з одного квантового стану в інший пояснювала цю дивину. Коли електрон переходив з одного енергетичного рівня на інший, де від нього була потрібна менша енергія, він випускав квант, що відбивалося на спектрограмме. Теорія Бора відразу ж продемонструвала здатність до прогнозування подальших змін в спектрах простих атомів начебто водню.
Недоліки
Теорія Бора не до кінця поривала з класичною фізикою. Вона як і раніше зберігала ідею орбітального руху електронів в електромагнітному полі ядра. Ідея про квантуванні при переході з одного стаціонарного стану в інший вдало доповнювала планетарну модель, але все ж не вирішувала всіх протиріч.
Хоча у світлі моделі Бора електрон не міг перейти в рух по спіралі і впасти на ядро, безперервно випромінюючи енергію, залишалося незрозумілим, чому він не міг послідовно підніматися на більш високі енергетичні рівні. В цьому випадку всі електрони рано чи пізно опинилися б у найнижчому енергетичному стані, що призвело б руйнування атома. Іншою проблемою стали аномалії в атомних спектрах, які теорія не пояснювала. Ще в 1896 році Пітер Зееман провів цікавий експеримент. Він помістив атомний газ в магнітне поле і зняв спектрограмму. Виявилося, що деякі спектральні лінії розщепилися на кілька. Такий ефект в теорії Бора пояснення не отримував.
Побудова моделі атома водню по Бору
Незважаючи на всі недоліки своєї теорії Нільс Бор зміг побудувати відповідну дійсності модель атома водню. При цьому він використовував правило частот і закони класичної механіки. Розрахунки Бору за визначенням можливих радіусів орбіт електрона і обчисленню енергії квантових станів виявилися досить точними і підтверджені експериментально. Частоти випромінювання і поглинання електромагнітних хвиль відповідали розташуванню темних проміжків спектрограммах.

Таким чином, на прикладі атома водню було доведено, що кожен атом являє собою квантову систему з дискретними енергетичними рівнями. Крім того, вчений зміг знайти спосіб поєднати класичну фізику і свої постулати з допомогою принципу відповідності. Він говорить, що квантова механіка включає в себе закони ньютонівської фізики. При певних умовах (наприклад, якщо квантове число було досить великим), квантова та класична механіка зближуються. Це доводилося тим, що при збільшенні квантового числа протяжність темних проміжків на спектрі зменшувалася аж до повного зникнення, як це і очікувалося у світлі ньютонівських уявлень.
Значення
Запровадження принципу відповідності стало важливим проміжним етапом на шляху до визнання існування особливої квантової механіки. Модель атома Бора стала для багатьох відправною точкою в конструюванні більш точних теорій руху субатомних частинок. Нільс Бор не зміг підібрати точної фізичної інтерпретації правилом квантування, але він і не міг цього зробити, оскільки лише з плином часу були виявлені хвильові властивості елементарних частинок. Луї де Бройль, доповнивши теорію Бору новими відкриттями, довів, що кожна орбіта, по якій рухається електрон, являє собою хвилю, що поширюється від ядра. З цієї точки зору стаціонарним станом атома стали вважати таке, що утворюється у випадку, коли хвиля, зробивши повний оборот навколо ядра, повторювалася.