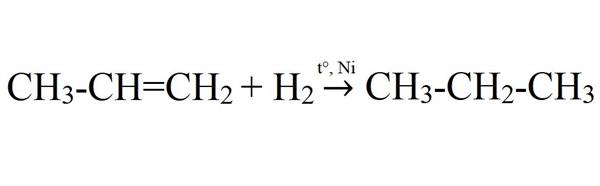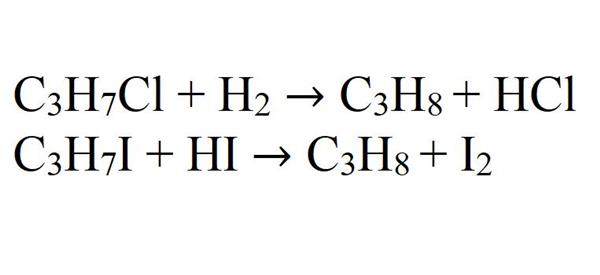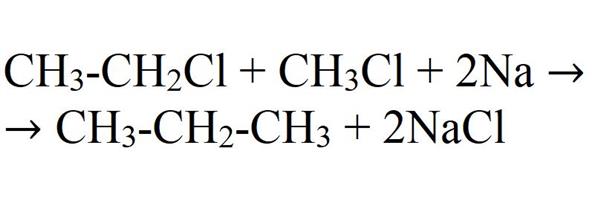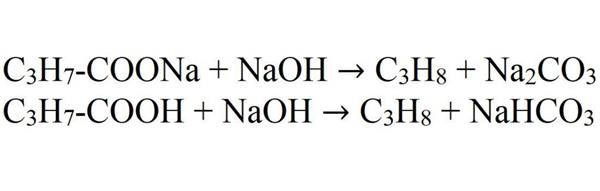Пропан — це органічна сполука, третій представник алканів в гомологическом ряду. При кімнатній температурі він являє собою газ без кольору і запаху. Хімічна формула пропану – c 3 h 8. Пожежо – і вибухонебезпечним. Має невеликий токсичністю. Він виявляє слабку дію на нервову систему і володіє наркотичними властивостями.
Будова
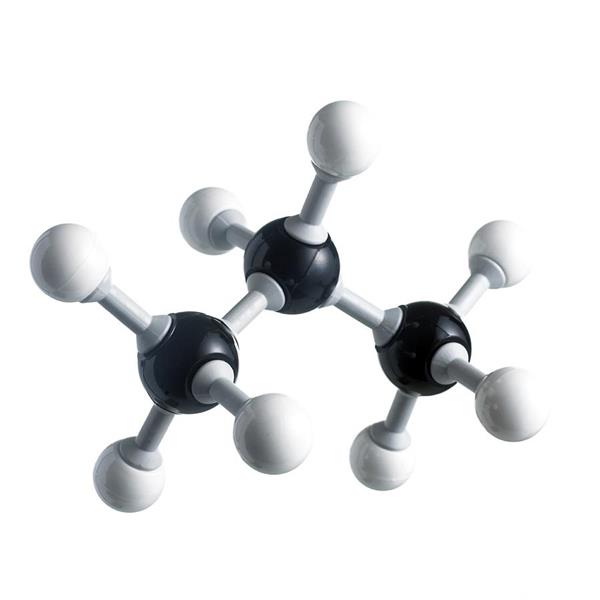
Пропан — це граничний вуглеводень, який складається з трьох атомів вуглецю. З цієї причини він має вигнуту форму, але з-за постійного обертання навколо осей зв’язків існує кілька молекулярних конформацій. Зв’язки в молекулі ковалентні: З-З неполярні, C-H слабополярные. З-за цього їх складно розірвати, а речовина досить важко вступає в хімічні реакції. Це і визначає всі хімічні властивості пропану. Ізомерів у нього немає. Молярна маса пропану – 44,1 г/моль.
Способи отримання
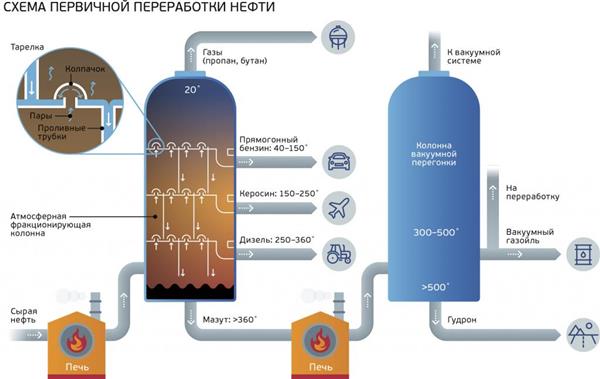
У промисловості пропан майже не синтезують штучно. Його виділяють з природного газу і нафти з допомогою перегонки. Для цього існують спеціальні виробничі установки.
В лабораторії пропан можна отримати наступними хімічними реакціями:
- Гідрування пропена. Дана реакція йде тільки при підвищенні температури та за наявності каталізатора (Ni, Pt, Pd).

- Відновлення галогенідів алканів. Для різних галогенідів застосовуються різні реагенти та умови.

- Синтез Вюрца. Його суть в тому, що дві молекули галогенаклкана зв’язуються в одну, реагуючи з лужним металом.

- Декарбоксилювання масляної кислоти і її солей.