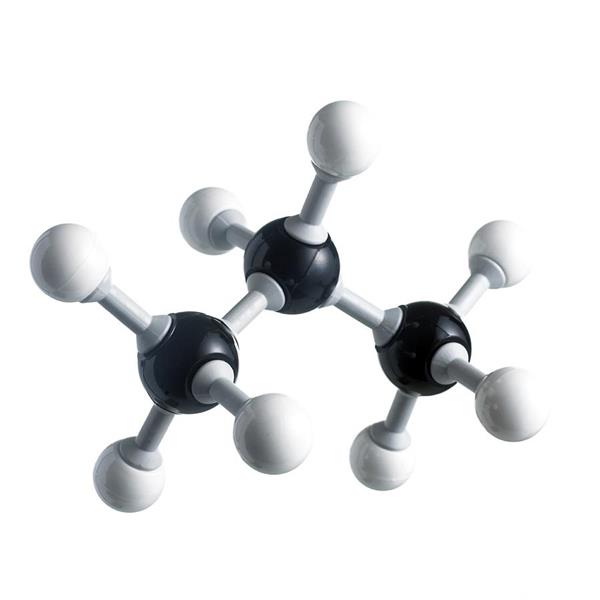
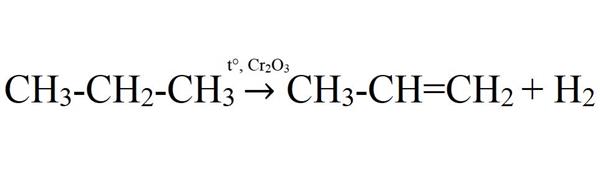Фізичні властивості пропану
Як вже згадувалося, пропан — це газ без кольору і запаху. Він не розчиняється у воді і інших полярних розчинниках. Зате розчиняється у деяких органічних речовинах (метанол, ацетон та інші). При – 42,1 °C зріджується, а при − 188 °C стає твердим. Вогненебезпечний, оскільки утворює з повітрям легкозаймисті та вибухонебезпечні суміші.
Хімічні властивості пропану
Вони являють собою типові властивості алканів.
- Каталітичне дегідрування. Здійснюється при 575 °C з використанням каталізатора оксиду хрому (III) або оксиду алюмінію.

- Галогенирование. Для хлорування та бромування потрібно ультрафіолетове випромінювання або підвищена температура. Хлор переважно заміщує крайній атом водню, хоча в деяких молекулах відбувається заміщення середнього. Підвищення температури може призвести до збільшення частки виходу 2-хлорпропана. Хлорпропан може галогенироваться і далі з утворенням дихлорпропана, трихлорпропана і так далі.
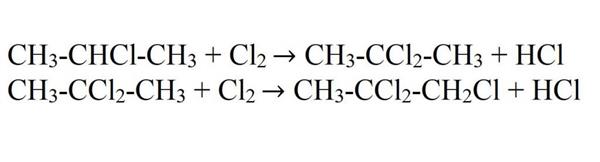
Механізм реакцій галогенирования — ланцюговий. Під дією світла або високої температури молекула галогену розпадається на радикали. Вони вступають у взаємодію з пропаном, відбираючи в нього атом водню. В результаті цього утворюється вільний пропив. Він взаємодіє з молекулою галогену, знову розбиваючи її на радикали.
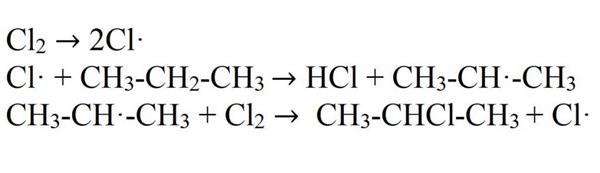
Бромирование відбувається за таким же механізмом. Йодування можна здійснювати тільки спеціальними йодовмісними реагентами, так як пропан не взаємодіє з чистим йодом. При взаємодії з фтором відбувається вибух, утворюється полизамещенное похідне пропану.
Нітрація може здійснюватися розведеною азотної кислотою (реакція Коновалова) або оксидом азоту (IV) при підвищеній температурі (130-150 °C).
Сульфоокисление і сульфохлорирование здійснюється при УФ-світлі.
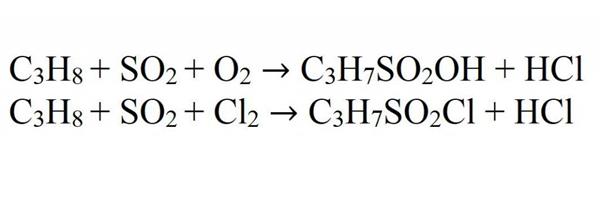
Реакція горіння пропану: c 3 h 8+ 5O2 → 3CO2 + 4h 2 o.
Можна провести і більш м’яке окислення, використовуючи певні каталізатори. Реакція горіння пропану буде інший. У цьому випадку отримують пропанол, пропаналь або пропіонова кислоти. В якості окислювачів, крім кисню, можуть використовуватися перекису (найчастіше перекис водню), оксиди перехідних металів, сполуки хрому (VI) і марганцю (VII).
Пропан реагує із сіркою з утворенням изопропилсульфида. Для цього в якості каталізаторів використовується тетрабромэтан і бромід алюмінію. Реакція йде при 20 °C протягом двох годин. Вихід реакції становить 60 %.
З тими ж каталізаторами може реагувати з оксидом вуглецю (I) з утворенням ізопропілового ефіру 2-метилпропановой кислоти. Реакційна суміш після реакції повинна бути оброблена ізопропанол. Отже, ми розглянули хімічні властивості пропану.