Телур – рідкісний хімічний елемент з атомним номером 52, що належить поряд з киснем, сіркою, селеном і полонієм до 16-ї групи періодичної системи, або, за старою класифікацією, до VI групі (де входить у головну підгрупу) таблиці Менделєєва. Будучи аналогом сірки і селену, телур утворює сполуки, структурно близькі аналогічним сірчистим і селенистым оксидам, кислот, солей. У числі таких сполук значиться і теллуровая кислота, властивості якої розглянуті в даній статті.
Склад і структура
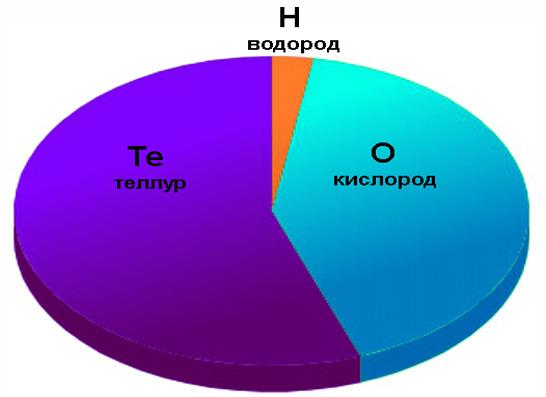
Кислота утворюється з телуру, що проявляє вищу ступінь окислення (+6). Формула телурової кислот: H6TeO6, або H2TeO4*2H2O. По масі кислота містить: телуру 55,6 %, кисню 41,8 % і водню – 2,6 %. З’єднання H2TeO4 – так звана метателлуровая або проста двухосновная кислота, солі якої добре відомі. У водному розчині поступово перетворюється в шестиосновную ортокислоту H6TeO6.
Просторово і структурно молекула являє собою октаедр, всі шість вершин якого утворені OH-групами, а в центрі розташований атом телуру, тому її раціональна формула, що відображає будову молекули, виглядає наступним чином: H6O6Te. Також можна записати формулу у вигляді Te(OH)6 – це теж буде правильно.

