Термодинаміка є важливим розділом фізики. Можна сміливо стверджувати, що її досягнення зумовили появу технологічної ери і визначили багато в чому хід людської історії за останні 300 років. У статті розглядаються перший, другий і третій закони термодинаміки і їх застосування на практиці.
Що таке термодинаміка?
Перш ніж наводити формулювання законів термодинаміки, розберемося, чим займається цей розділ фізики.
Слово “термодинаміка” має грецьке походження і означає “рух завдяки теплу”. Тобто цей розділ фізики займається вивченням будь-яких процесів, в результаті яких теплова енергія перетворюється в механічне рух і навпаки.
Основні закони термодинаміки були сформульовані в середині XIX століття. Наука про рух і теплі” розглядає поведінку всієї системи в цілому, вивчаючи зміну її макроскопічних параметрів – температури, тиску і об’єму, і не звертаючи увагу на її мікроскопічна будова. Причому перший з них відіграє принципову роль у формулюванні законів термодинаміки у фізиці. Цікаво відзначити, що виведені вони виключно з експериментальних спостережень.
Поняття про термодинамічної системи

Під ним розуміють будь-яку групу атомів, молекул або інших елементів, які розглядаються як єдине ціле. Всі три закони формулюються для так званої термодинамічної системи. Прикладами є: атмосфера Землі, будь-який живий організм, газова суміш в двигуні внутрішнього згоряння та ін
Всі системи в термодинаміці відносяться до одного з трьох типів:
- Відкриті. В них існує обмін як теплом, так і речовиною з навколишнім середовищем. Наприклад, якщо в казані на відкритому вогні готується їжа, то це яскравий приклад відкритої системи, оскільки казанок отримує енергію від зовнішнього середовища (багаття), при цьому він сам випромінює енергію у вигляді тепла, а також з нього випаровується вода (обмін речовиною).
- Закриті. У таких системах не існує обміну речовиною з середовищем, хоча відбувається обмін енергією. Повертаючись до попереднього випадку: якщо накрити кришкою казанок, то можна отримати систему закритого типу.
- Ізольовані. Це вид термодинамічних систем, які ні речовиною, ні енергією не обмінюються з навколишнім простором. Прикладом може служити термос, в якому знаходиться гарячий чай.
Термодинамічна температура

Під цим поняттям розуміють кінетичну енергію частинок, що утворюють навколишні тіла, яка відображає швидкість хаотичного переміщення частинок. Чим вона більше, тим вище температура. Відповідно, зменшуючи кінетичну енергію системи, ми її охолоджуємо.
Під цим поняттям розуміють кінетичну енергію частинок, що утворюють навколишні тіла, яка відображає швидкість хаотичного переміщення частинок. Чим вона більше, тим вище температура. Відповідно, зменшуючи кінетичну енергію системи, ми її охолоджуємо.
Термодинамічна температура виражається в СІ (Інтернаціональна система одиниць вимірювань) в кельвінах (на честь британського вченого Вільяма Кельвіна, який запропонував вперше цю шкалу). Розуміння першого, другого та третього законів термодинаміки неможливо без визначення температури.
Поділ в один градус за шкалою Кельвіна відповідає одному градусу за Цельсієм. Переклад між цими одиницями здійснюється за формулою: TK = TC + 273,15, де TK і TC – температури в кельвінах і градусах Цельсія відповідно.
Особливістю шкали Кельвіна є те, що вона не має від’ємних значень. Нуль в ній (TC = -273,15 oC) відповідає стану, коли тепловий рух частинок системи повністю відсутня, вони виявляються як би “замороженими”.
Збереження енергії і 1 закон термодинаміки

У 1824 році Нікола Леонар Саді Карно, французький інженер і фізик, висунув сміливе припущення, яке не тільки зумовило розвиток фізики, але і стало найважливішим кроком для вдосконалення технологій. Його можна сформулювати наступним чином: “Енергія не може бути створена або знищена, вона може бути переведена лише з одного стану в інший”.
По суті фраза Саді Карно постулює закон збереження енергії, який ліг в основу 1 закону термодинаміки: “Всякий раз, коли система отримує енергію ззовні, вона переводить її в інші форми, основними з яких є теплова та механічна”.
Математична формула для 1-го закону записується так:
Q = ΔU + A
тут Q – кількість теплоти, передане навколишнім середовищем системі, ΔU – зміна внутрішньої енергії цієї системи, A – досконала механічна робота.
Адіабатичні процеси
Наочним прикладом їх є рух повітряних мас уздовж гірських схилів. Такі маси володіють величезними розмірами (кілометри і більше), а повітря є прекрасним теплоізолятором. Зазначені властивості дозволяють розглядати будь-які процеси з повітряними масами, які відбуваються протягом короткого часу, як адіабатичні. Коли повітря піднімається по гірському схилу, то його тиск падає, він розширюється, тобто виконує механічну роботу, і, як наслідок, охолоджується. Навпаки, рух повітряної маси вниз супроводжується збільшенням тиску в ній, вона стискається і за рахунок цього сильно нагрівається.
Застосування закону термодинаміки, який розглянуто в попередньому підзаголовку, найпростіше продемонструвати на прикладі адіабатичного процесу.
Згідно з визначенням, в результаті нього не відбувається обмін енергією з навколишнім середовищем, тобто в рівнянні вище Q = 0. Це приводить до наступного виразу: ΔU = -A. Знак мінус означає, що система здійснює механічну роботу за рахунок зменшення власної внутрішньої енергії. Слід нагадати, що внутрішня енергія знаходиться в прямій залежності від температури системи.
Напрямок протікання теплових процесів
Цим питанням займається 2-й закон термодинаміки. Напевно кожен помічав, що якщо привести в контакт два предмети з різною температурою, то холодний завжди буде нагріватися, а гарячий охолоджуватися. Зазначимо, що зворотний процес може відбуватися в рамках першого закону термодинаміки, однак він ніколи не реалізується на практиці.
Причиною незворотності зазначеного процесу (і всіх відомих процесів у Всесвіті) є перехід системи в більш ймовірне стан. У розглянутому прикладі контакту двох тіл різної температури найбільш вірогідним станом буде той, при якому всі частинки системи будуть мати однакову кінетичну енергію.
Другий закон термодинаміки може бути сформульований так: “Тепло спонтанно ніколи не може бути передано від холодного тіла до гарячого”. Якщо ввести поняття ентропії як міри безладдя, тоді його можна представити в такому вигляді: “Будь-який термодинамічний процес протікає зі збільшенням ентропії”.
Теплова машина

Під цим терміном розуміють систему, яка завдяки підводу до неї зовнішньої енергії може здійснювати механічну роботу. Теплові машини були паровими і були винайдені в кінці XVII століття.
Другий закон термодинаміки відіграє визначальну роль у визначенні їх ефективності. Ще Саді Карно встановив, що максимальний ККД цього пристрою дорівнює: ККД = (T2 – T1)/T2, тут T2 і T1 – температури нагрівача і холодильника. Механічна робота може бути здійснена лише тоді, коли існує потік теплоти від гарячого тіла до холодного, причому цей потік неможливо на 100% переводити в корисну енергію.
Нижче наведено малюнок, де зображено принцип роботи теплової машини (Qabs – передане тепло машині, Qced – теплові втрати, W – корисна робота, P і V – тиск і об’єм газу в поршні).
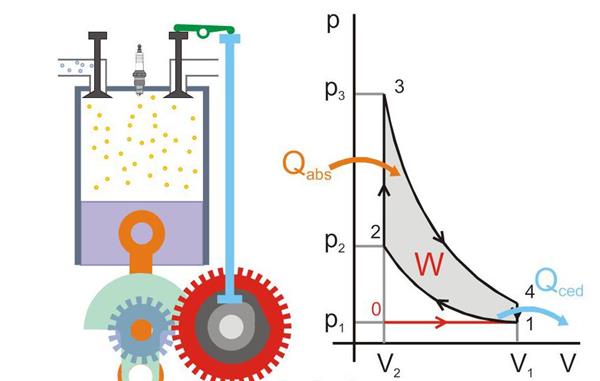
Абсолютний нуль і постулат Нернста
Нарешті, перейдемо до розгляду третього закону термодинаміки. Він також називається постулатом Нернста (прізвище німецького фізика, який вперше його сформулював на початку XX століття). Закон говорить: “З допомогою кінцевого числа процесів не можна досягти абсолютного нуля”. Тобто неможливо ніяким способом повністю “заморозити” молекули і атоми речовини. Причиною цього є постійною існуючий теплообмін з навколишнім середовищем.

Один з висновків, зроблених з третього закону термодинаміки, полягає у зменшенні ентропії при русі до абсолютного нуля. Це означає, що система прагне організуватися. Цей факт можна використовувати, наприклад, для перекладу парамагнетиків у феромагнітний стан при охолодженні.
Цікаво відзначити, що найменшої температури, якої вдалося досягти в даний час, є значення 5·10-10 K (2003 рік, лабораторія Массачусетського Технологічного Інституту, США).

