Що таке нітробензол? Це органічна сполука, яка являє собою ароматичне ядро і приєднану до нього нітрогрупу. За зовнішнім виглядом, залежно від температури, — це яскраво-жовті кристали або масляниста рідина. Має мигдалевих запах. Токсичний.
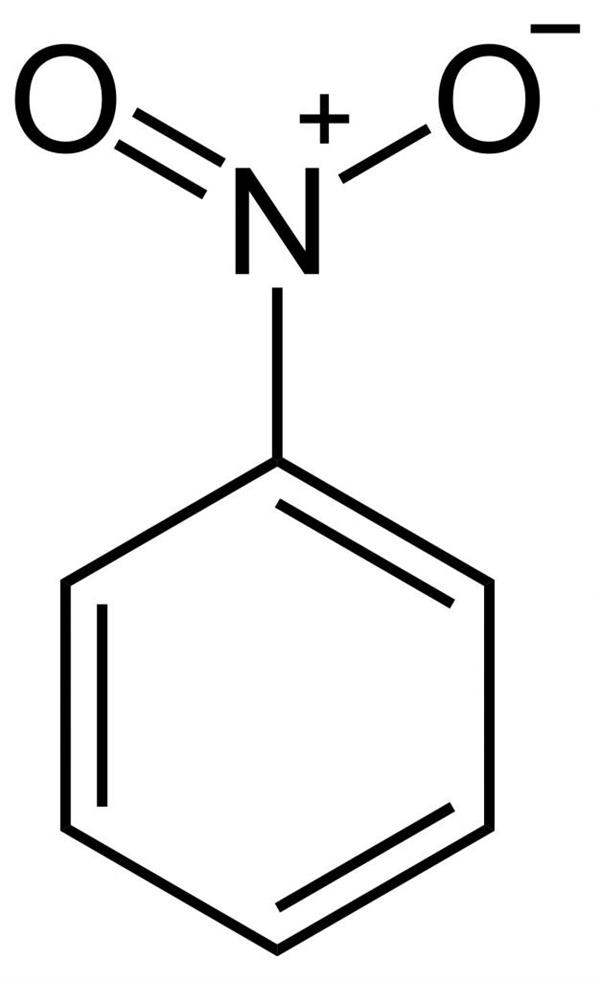
Структурна формула нітробензолу
Нитрогруппа — це дуже сильний акцептором електронної щільності. Тому молекула нітробензолу володіє негативним індуктивним і негативним мезомерным ефектом. Нитрогруппа досить сильно притягує на себе електронну густину ароматичного ядра, дезактівіруя його. Электрофильные реагенти вже не так сильно притягуються до ядра, і тому нітробензол не так активно набирає подібні реакції. Щоб приєднати безпосередньо до нитробензолу ще одну нітрогрупу, потрібні дуже жорсткі умови, набагато більш жорсткі, ніж при синтезі мононітробензола. Теж саме стосується галогенів, сульфогрупи та ін.
З структурної формули нітробензолу видно, що одна зв’язок азоту з киснем одинарна, а інша — подвійна. Але насправді, з-за мезомерного ефекту, вони обидві рівнозначні і мають однакову довжину 0,123 нм.
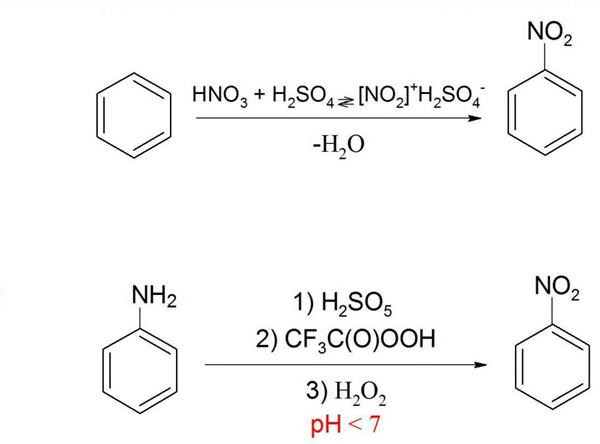
Отримання нітробензолу в промисловості
Нітробензол — важливий проміжний продукт у синтезі багатьох речовин. Тому його виробляють у промислових масштабах. Основний спосіб отримання нітробензолу — це нітрування бензолу. Зазвичай для цього використовують нітрит суміш (суміш концентрованих сірчаної та азотної кислоти). Реакцію ведуть 45 хвилин при температурі близько 50 °C. Вихід нітробензолу становить 98 %. Саме тому даний спосіб в основному застосовують у промисловості. Для його реалізації існують спеціальні установки як періодичного, так і безперервного типу. На 1995 р виробництво нітробензолу в США становило 748 000 тонн в рік.
Нітрування бензолу можна також вести просто концентрованої азотної кислотою, але у такому разі вихід продукту буде нижче.
Отримання нітробензолу в лабораторії
Існує ще один спосіб отримання нітробензолу. В якості сировини тут використовується анілін (аминобензол), який окислюють пероксисоединениями. Завдяки цьому аміногрупа замінюється на нітрогрупу. Але в ході цієї реакції утворюється кілька побічних продуктів, що заважає ефективно використовувати цей спосіб у промисловості. Тим більше, нітробензол в основному і використовують для синтезу аніліну, тому застосовувати анілін для виробництва нітробензолу не має сенсу.
Фізичні властивості
При кімнатній температурі нітробензол являє собою безбарвну маслянисту рідина з запахом гіркого мигдалю. При температурі 5,8 °C вона твердне, перетворюючись в жовті кристали. При 211 °C нітробензол кипить, а при 482 °C самозаймається. Дана речовина, майже як будь-ароматична сполука, нерозчинна у воді, зате добре розчинно у органічних сполуках, особливо в бензолі. Також він може навперегін водяною парою.

Электрофильное заміщення
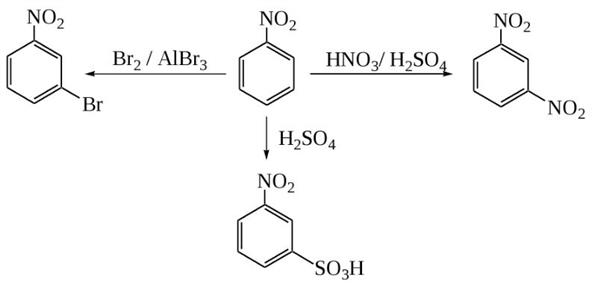
Для нітробензолу, як і для будь-якого арена, характерні реакції електрофільного заміщення в ядро, хоча вони і дещо ускладнені у порівнянні з бензолом через вплив нітрогрупи. Так, з нітробензолу можна отримати динитробензол шляхом подальшого нітрування сумішшю азотної і сірої кислот при підвищеній температурі. Отриманий продукт буде переважно (93 %) складатися з мета-динитробензола. Можливо навіть отримання тринитробензола прямим шляхом. Але для цього необхідно використати ще більш жорсткі умови, а також трехфтористый бор.
Точно так само нітробензол може сульфироваться. Для цього використовують дуже сильний сульфирующий реагент – олеум (розчин оксиду сірки VI в сірчаній кислоті). Температура реакційної суміші повинна становити не менше 80 °C. Ще одна реакція електрофільного заміщення — пряме галогенирование. В якості каталізаторів використовують сильні кислоти Льюїса (хлорид алюмінію, трехфтористый бор та ін), а також підвищену температуру.
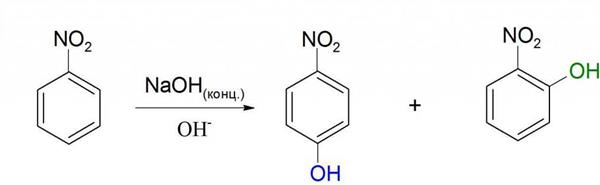
Нуклеофильное заміщення
Як видно із структурної формули, нітробензол може вступати в реакції з сильними электронодонорными сполуками. Це можливо через вплив нітрогрупи. Прикладом такої реакції може служити взаємодія з концентрованими або твердими гідроксидами лужних металів. Але в цій реакції не утворюється нітробензол натрію. Хімічна формула нітробензолу передбачає швидше приєднання гідроксильної групи в ядро, тобто утворення нітрофенолу. Але відбувається це тільки при досить жорстких умовах.
Подібна реакція протікає і з магнийорганическими сполуками. Вуглеводневий радикал приєднується до ядра в орто – або пара – положення до нитрогруппе. Побічним процесом в цьому випадку є відновлення нітрогрупи до аміногрупи. Реакції нуклеофільного заміщення йдуть простіше, якщо нитрогрупп кілька, так як вони ще сильніше будуть відтягувати на себе електронну щільність ядра.
Реакція відновлення
Як відомо, нітросполуки можуть відновлюватися до амінів. Не є винятком і нітробензол, формула якого передбачає можливість цієї реакції. Вона часто застосовується в промисловості для синтезу аніліну.
Але нітробензол може давати і дуже багато інших продуктів відновлення. Найчастіше використовують відновлення атомарним воднем у момент його виділення, тобто в реакційній суміші проводять реакцію взаємодії кислоти з металом, і виділяється водень вступає в реакцію з нитробензолом. Зазвичай при такій взаємодії виходить анілін.
Якщо на нітробензол подіяти цинковим пилом у розчині хлориду амонію, то продуктом реакції буде N-фенилгидроксиламин. Це з’єднання досить легко може бути відновлено стандартним способом до аніліну, або ж окислена назад в нітробензол сильним окислювачем.
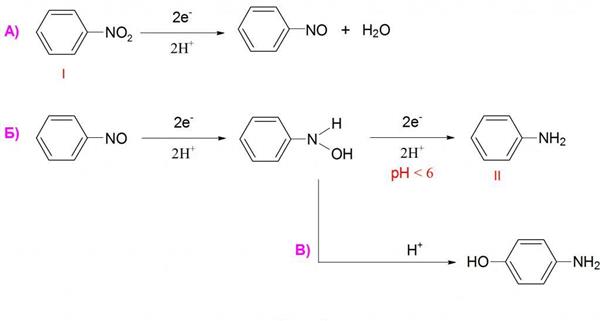
Відновлення також може вестися в газовій фазі молекулярним воднем в присутності платини, паладію або нікелю. У цьому випадку також виходить анілін, але існує ймовірність відновлення самого бензольного ядра, що часто небажано. Іноді також застосовують такий каталізатор, як нікель Ренея. Він являє собою пористий нікель, насичений воднем і містить 15 % алюмінію.
При відновлення нітробензолу алкоголятами калію або натрію утворюється азоксибензол. Якщо використовувати більш сильні відновники в лужному середовищі, то виходить азобензол. Ця реакція також досить важлива, так як з її допомогою синтезують деякі барвники. Азобензол може бути піддана подальшому відновленню в лужному середовищі до утворення гидразобензола.
Спочатку відновлення нітробензолу проводилося сульфідом амонію. Цей спосіб в 1842 р запропонував Зінін Н. Н., тому реакція носить його ім’я. Але зараз її вже рідко застосовують на практиці із-за низького виходу.
Застосування
Сам по собі нітробензол застосовують дуже рідко, тільки як селективний розчинник (наприклад, для ефірів целюлози) або м’який окисник. Іноді його додають в полірувальні розчини для металів.
Майже весь вироблений нітробензол використовується для синтезу інших корисних речовин (наприклад, аніліну), які, в свою чергу, використовуються для синтезу лікарських препаратів, барвників, полімерів, вибухових речовин і ін

Небезпека
З-за своїх фізичних і хімічних властивостей, нітробензол — дуже небезпечне з’єднання. Він має третій рівень небезпеки для здоров’я з чотирьох за стандартом NFPA 704. Крім того, що він може потрапити в організм при диханні або через слизові оболонки, він також всмоктується через шкіру. При отруєнні великою концентрацією нітробензолу людина може втратити свідомість і померти. При невеликих концентраціях симптомами отруєння є нездужання, запаморочення, шум у вухах, нудота і блювота. Особливість отруєння нитробензолом — висока швидкість зараження. Симптоми проявляються дуже швидко: порушуються рефлекси, кров набуває темно-бурий колір через утворення в ній метгемоглобіну. Іноді можуть бути висипання на шкірі. Концентрація, достатня для відправлення, дуже мала, хоча точних даних по смертельній дозі немає. У спеціальній літературі часто зустрічається інформація, що 1-2 краплі нітробензолу вистачає, щоб убити людину.
Лікування
При отруєнні нитробензолом потерпілого необхідно негайно видалити з токсичною зони і позбавити його від забрудненого одягу. Тіло обмивають теплою водою з милом, щоб видалити нітробензол з шкіри. Кожні 15 хвилин потерпілому роблять інгаляцію карбогеном. При легких отруєннях необхідно приймати цистамин, піридоксин або ліпоєвої кислоти. У більш важких випадках рекомендується використовувати метиленовим синь або внутрівенно хромосмон. При отруєнні нитробезнолом через рот необхідно негайно викликати блювання і промити шлунок теплою водою. Протипоказано приймати будь-який жир, в тому числі і молоко.

