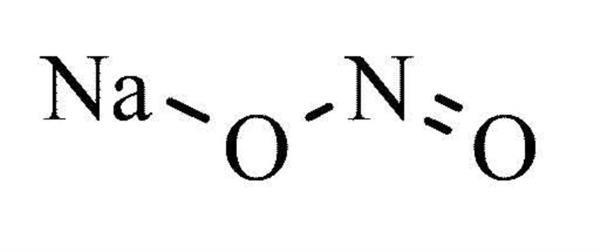Нітрит-іон — це іон, що складається з одного атома азоту і двох атомів кисню. Азот в цьому іоні має заряд +3, отже заряд всього іона -1. Частка одновалентна. Формула нітрит-іона NO2-. Аніон має нелінійну конфігурацію. Сполуки, що містять цю частку, називаються нітритами, наприклад нітриту натрію NaNO2, нітрит срібла — AgNO2.
Фізичні і хімічні властивості
Нітрити лужних, лужноземельних металів та амонію являють собою безбарвні чи злегка жовтуваті кристалічні речовини. Нітрити калію, натрію, барію у воді добре розчиняються, нітрити срібла, ртуті, міді – погано. З підвищенням температури розчинність підвищується. Практично всі нітрити погано розчиняються у ефірах, спиртах і малополярних розчинниках.
Таблиця. Фізичні характеристики деяких нітритів.
| Характеристика | Нітрит калію | Нітрит срібла | Нітрит кальцію | Нітрит барію |
|
Тпл, °З |
440 |
120 (з разлож.) |
220 (з разлож.) |
277 |
|
∆Н0обр, кДж/моль |
– 380,0 | – 40,0 | -766,0 | – 785,5 |
| S0298, Дж/(моль*К) | 117,2 | 128,0 | 175,0 | 183,0 |
| Розчин-ть у воді, г в 100 г |
306,7 (200С) |
0,41 (250С) |
84,5 (180С) |
67,5 (200С) |
Нітрити малостійкі до нагрівання: плавляться без розкладання тільки нітрити лужних металів. У результаті розкладання виділяються газоподібні продукти — O2 , NO, N2, NO2, і тверді речовини — оксид металу або сам метал. Наприклад, розкладання нітриту срібла(йде вже при 40 °С) супроводжується виділенням елементного срібла і оксиду азоту (II):
2AgNO2 = Agno 3 + Ag + NO↑
Оскільки розкладання йде з виділенням великої кількості газів, реакція може йти з вибухом, наприклад, у разі нітриту амонію.
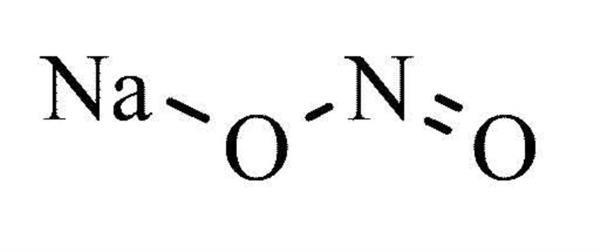
Окисно-відновні властивості
Атом азоту нітрит-іони має проміжний заряд +3, ось чому для нітритів характерні як окислювальні, так і відновні властивості. Наприклад, нітрити будуть знебарвлювати розчин калію перманганату в кислому середовищі, виявляючи властивості окислювача:
5KNO2 + 2KMnO4 +3H2SO4 = 3H2O + 5KNO3 + 2MnSO4 + K2SO4
Властивості відновника нітрит-іони проявляють, наприклад, у реакції з міцним розчином пероксиду водню:
NO2- + H2O2 = NO3- + H2O
Відновником є нітрит при взаємодії з броматом срібла (підкислений розчин). Ця реакція використовується в хімічному аналізі:
2NO2- + Ag+ + BrO2- = 2NO3- + AgBr↓
Ще одним прикладом відновлювальних властивостей є якісна реакція на нітрит-іон — взаємодія безбарвних розчинів [Fe(H2O)6]2+ з підкисленім розчином нітриту натрію з появою бурого фарбування.

Теоретичні основи виявлення NO2
Азотиста кислота при нагріванні диспропорционирует з утворенням оксиду азоту (II) і азотної кислоти:
HNO2 + 2HNO2 = NO3- + H2O + 2NO↑ + H+
Тому азотисту кислоту неможливо відокремити від азотної кип’ятінням. Як видно з рівняння, азотиста кислота, розкладаючись, частково перетворюється в азотну, що призведе до помилок у визначенні вмісту нітратів.
Майже всі нітрити розчиняються у воді, найменш розчинним з цих сполук є нітрит срібла.
Нітрит-іон сам безбарвний, тому його виявляють реакціями утворення інших забарвлених сполук. Нітрити нефарбованих катіонів також безбарвні.

Якісні реакції
Існує кілька якісних способів визначення нітрит-іонів.
1. Реакція утворення K3[Co(NO2)6].
У пробірку вміщують 5 крапель досліджуваного розчину, що містить нітрит, 3 краплі розчину нітрату кобальту, 2 краплі оцтової кислоти (розведеної), 3 краплі розчину хлориду калію. Утворюється гексанитрокобальтат (III) K3[Co(NO2)6] – жовтий кристалічний осад. Нітрат-іон в досліджуваному розчині не заважає виявленню нітритів.
2. Реакція окислення йодидів.
Нітрит-іони окислюють йодид-іони в кислому середовищі.
2HNO2 + 2I- + 2H+ = 2NO↑ + I2↓ + 2H2O
У ході реакції утворюється елементарний йод, який легко виявити фарбуванням крохмалю. Для цього реакцію можна проводити на фільтрувальному папері, попередньо просоченої крохмалем. Реакція дуже чутлива. Синій колір з’являється навіть при наявності слідів нітритів: відкривається мінімум – 0,005 мкг.
Фільтрувальний папір просочують крохмальним розчином, на неї додають 1 краплю 2н розчину оцтової кислоти, 1 краплю дослідного розчину, 1 краплю 0,1 н розчину иодида калію. При наявності нітриту з’являється синє кільце або пляму. Виявлення заважають інші окислювачі, що призводять до утворення йоду.
3. Реакція з перманганатом калію.
У пробірку поміщають 3 краплі розчину калію перманганату , 2 краплі сірчаної кислоти (розведеної). Суміш потрібно нагріти до 50-60 °С. обережно Додають кілька крапель нітриту натрію або калію. Розчин перманганату знебарвлюється. Інші відновники, присутні в досліджуваному розчині, здатні окислити перманганат-іон, будуть заважати виявленню NO2-.
4. Реакція з сульфатом заліза (II).
Сульфат заліза відновлює нітрит в нітрат в кислому середовищі (розбавлена сірчана кислота):
2KNO2 (тв.) + 2H2SO4 (разб.) + 2FeSO4 (тв.) = 2NO↑ + K2SO4 + Fe2(SO4)3 + 2H2O
Отриманий оксид азоту (II) утворює з надлишком Fe2+ (не встигли ще вступити в реакцію) комплексні іони бурого кольору:
NO + Fe2+ = [FeNO]2+
NO + FeSO4 = [FeNO]SO4
Слід врахувати, що з розбавленою сірчаною кислотою реагують нітрити, а з концентрованою будуть реагувати нітрати. Тому для виявлення нітрит-іона необхідна саме розбавлена кислота.
5. Реакція з антипірином.
NO2 – з антипірином в кислому середовищі дає розчин зеленого кольору.
6. Реакція з риванолом.
NO2 – з риванолом, або этакридином (I) в кислому середовищі дає розчин червоного кольору.

Кількісне визначення вмісту нітритів у воді
За Гостом кількісний вміст нітрит-іонів у воді визначають двома фотометричними методами: з використанням сульфаниловой кислоти і з використанням 4-аминобензолсульфонамида. Перший з них є арбітражним.
З-за нестійкості нітритів їх потрібно визначати відразу після взяття проб або ж консервувати проби додаванням на 1 л води 1 мл сірчаної кислоти (концентрованої) або 2-4 мл хлороформу; можна охолодити пробу до 4 °С.
Каламутну чи кольорову воду очищають гідроокисом алюмінію, додаючи 2-3 мл суспензії на 250-300 мл води. Суміш струшують, для аналізу відбирають прозорий шар після освітлення.
Визначення вмісту нітритів з допомогою сульфаниловой кислоти

Сутність методу: нітрити аналізованої проби взаємодіють з сульфаниловой кислоти, отримана сіль реагує 1-нафтиламином з виділенням червоно-фіолетового азокрасителя, його кількість визначають фотометрически, потім проводять розрахунок концентрації нітритів в пробі води. 1-нафтіламін і сульфанілова кислота і входять до складу реактиву Грісса.
Визначення нітрит-іонів: методика
До 50 мл проби води доливають 2 мл розчину реактиву Грісса в оцтовій кислоті. Перемішують і витримують 40 хв при звичайній температурі або 10 хв при 50-60 °С на водяній бані. Потім заміряють оптичну щільність суміші. У ролі холостий проби застосовують дистильовану воду, яку готують аналогічно аналізованої пробі води. Концентрацію нітритів розраховують за формулою:
X=K∙A∙50∙f / V,
де: K – коефіцієнт градуювальної характеристики,
A – встановлене значення оптичної щільності аналізованої проби води за вирахуванням встановленого значення оптичної щільності холостий проби,
50 – об’єм мірної колби,
f – коефіцієнт розведення (якщо пробу не розбавляли, f=1),
V – обсяг аликвоты, взятої для аналізу.

Нітрити у воді
Звідки нітрит-іони в стічних водах? Нітрити в невеликій кількості завжди присутні в дощовій воді, поверхневих і підземних водах. Нітрити — проміжний щабель у перетвореннях азотовмісних речовин, що здійснюються бактеріями. Ці іони утворюються при окисленні катіона амонію до нітратів (у присутності кисню) і при протилежних реакціях – відновлення нітратів до аміаку або азоту (при нестачі кисню). Всі ці реакції здійснюються бактеріями, а джерелом азотовмісних речовин є органіка. Тому кількісний вміст нітритів у воді – важливий санітарний показник. Перевищення норм вмісту нітритів свідчить про фекальне забруднення вод. Потрапляння стоків тваринницьких ферм, заводів, промислових підприємств, забруднення водоймищ водами з полів, де застосовувалися азотні добрива – основні причини високого вмісту нітритів у воді.

Отримання
У промисловості нітрит натрію отримують абсорбцією нитрозного газу (суміш NO і NO2) розчинами NaOH або Na2CO3 з подальшою кристалізацією нітриту натрію:
NO + NO2 + 2NaOH (хол.)= 2NaNO2 + H2O
Реакція в присутності кисню йде з утворенням нітрату натрію, тому необхідно забезпечити безкисневі умови.
Таким же методом в промисловості отримують і нітрит калію. Крім того, нітрити натрію та калію можна отримати окисленням нітратом свинцю:
KNO3 (конц) + Pb (губка) + H2O = KNO 2 + Pb(OH)2↓
KNO3 + Pb = KNO 2 + PbO
Остання реакція йде при температурі 350-400 °С.