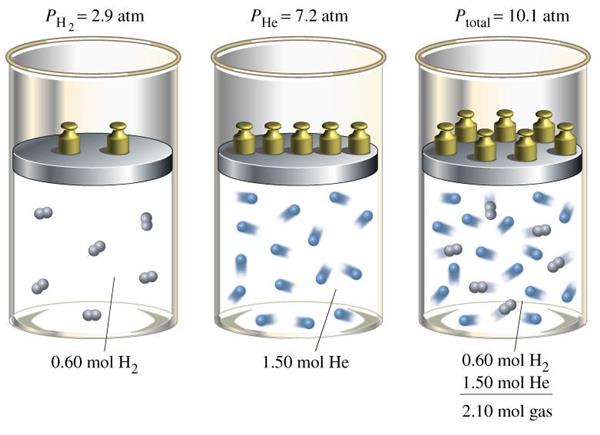
Газові суміші і закон Дальтона

Джон Дальтон, вивчаючи різні леткі, включаючи водяна пара, при різних температурах і тисках, прийшов до наступного висновку: тиск суміші абсолютно будь-яких подібних речовин у будь-яких пропорціях дорівнює сумі парціальних тисків всіх його компонентів. Ця формулювання називається законом Дальтона для тиску суміші газів і записується наступним математичним рівнянням:
Ptot = ∑i(Pi)
Тут Ptot – повний тиск суміші.
Цей досить простий закон виконується тільки для ідеальних газових сумішей, компоненти яких хімічно не взаємодіють один з одним.
Інша формулювання закону Дальтона

Закон Дальтона для суміші газів може бути виражений не лише через парціальні тиску, але також через мольні частки кожного компонента. Отримаємо відповідну формулу.
Оскільки кожен компонент веде себе незалежно від інших у газовій суміші, тоді для нього можна записати рівняння стану:
Pi*V = ni*R*T
Це рівняння справедливе для кожного i-го компонента, оскільки для всіх них температура T і об’єм V є однаковими. Величина ni – кількість молей компонента i в суміші.
Виразимо тепер парціальний тиск, і розділимо його на повне тиск всієї суміші, тоді отримаємо:
Pi/Ptot = ni*R*T / V / (n *R*T/V) = ni/n
Тут n – загальна кількість речовини у всій суміші. Його можна отримати, якщо підсумувати всі ni. Відношення ni/n називається мольной часткою компонента i в суміші. Її зазвичай позначають символом xi. Через мольні частки закон Дальтона записується так:
Pi = Ptot*xi
Мольна частка часто представляється у вигляді атомних відсотків компонентів у суміші. Наприклад, 21 % O2 в повітрі говорить про те, що його мольна частка дорівнює 0,21, тобто кожна п’ята молекула повітря є киснем.