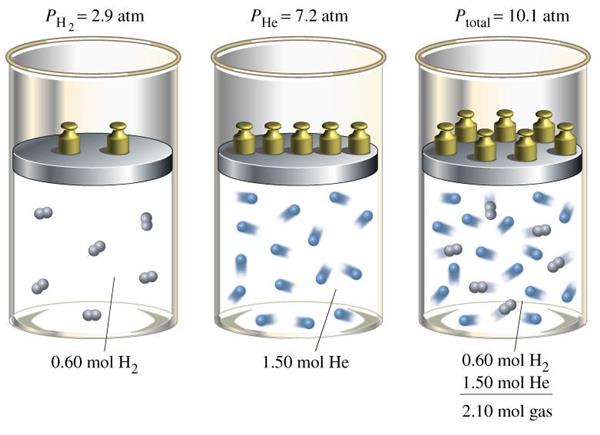
Застосування розглянутого закону для вирішення завдання

Відомо, що газова суміш кисню і азоту знаходиться під тиском 5 атмосфер в балоні. Знаючи, що в ньому міститься 10 моль азоту і 3 моль кисню, необхідно визначити парціальний тиск кожного речовини.
Щоб відповісти на запитання задачі, знайдемо спочатку загальна кількість речовини:
n = nN2 + nO2 = 10 + 3 = 13 міль
Тепер можна розрахувати мольную частку кожного компонента в суміші. Маємо:
xN2 = nN2/n = 10/13 = 0,7692
xO2 = nO2/n = 3/13 = 0,2308
Користуючись формулою закону Дальтона через мольную частку компонента, розраховуємо парціальний тиск кожного газу в балоні:
PN2 = 5*0,7692 = 3,846 атм.
PO2 = 5*0,2308 = 1,154 атм.
Як видно з отриманих цифр, сума цих тисків дасть 5 атмосфер. Парціальний тиск кожного газу прямо пропорційна його мольной частки в суміші.