Положення в періодичній системі
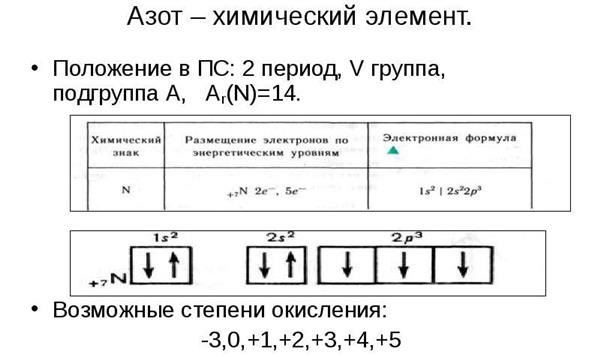
Азот – елемент п’ятої групи головної підгрупи) у таблиці Менделєєва Д. І.. Його відносна атомна маса – 14, порядковий номер 7. В ядрі сім позитивних протонів і сім нейтронів, навколо ядра по двом орбітах рухається сім електронів. Азот проявляє наступні валентності: II, IV, V, III. Його окислювальна здатність виражена яскравіше, ніж у фосфору з-за меншого радіусу атома.
Характеристика азоту за планом (9 клас) передбачає розподіл електронів по енергетичних рівнях: 2, 5, а також складання формули вищого оксиду – N2O5. Враховуючи, що азот є хімічно інертним елементом, отримати дане з’єднання досить складно. Летючим водневим з’єднанням є аміак – NH3.

Знаходження в природі
Характеристика азоту за планом (9 клас) передбачає зазначення основних сполук, що знаходяться в природі, а також поширеності азоту у вигляді простої речовини.
Він є одним з найбільш поширених на нашій планеті елементів. В атмосфері 78 % азоту за обсягом без урахування домішок (оксидів і аміаку). З природних сполук інтерес становлять нітрати (селітри). Протягом тривалого часу саме вони використовувалися для промислового синтезу аміаку.
Азот накопичується в живих організмах (у вигляді білкових сполук) і в грунті. Характеристика азоту за планом (9 клас) передбачає опис кругообігу азоту в природі. У підручнику О. С. Габриеляна є схема, за якої учні можуть скласти хімічні рівняння процесів, що протікають.