Кінетичні залежності ферментативної реакції за участю конкурентного інгібітору
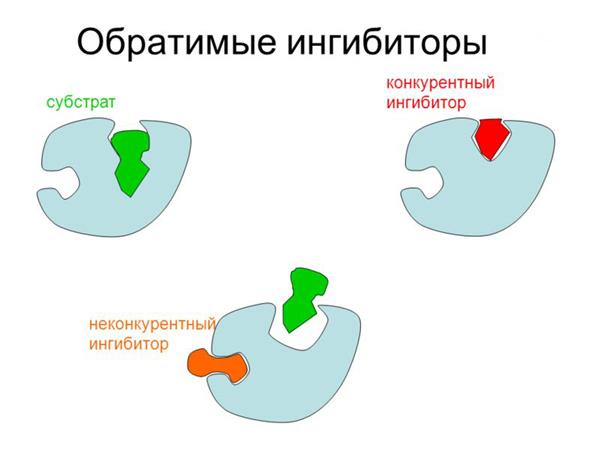
Конкурентне інгібування збільшує константу Міхаеліса (Km), яка дорівнює концентрації субстрату, необхідної для досягнення ½ максимальної швидкості каталізу на початку реакції. Кількість ферменту, гіпотетично здатну зв’язатися з субстратом, залишається постійним, а число фактично утворюються ES-комплексів залежить тільки від концентрації останнього (комплекси EI не постійні і можуть бути витіснені субстратом).
Конкурентне інгібування ферментів легко визначити за графіками кінетичної залежності, побудованим для різних концентрацій субстрату. В цьому випадку величина Km буде змінюватися, а Vmax залишатися постійною величиною.

При неконкурентному інгібуванні все навпаки: інгібітор зв’язується поза активного центру і присутність субстрату ніяк не може на це вплинути. В результаті частина молекул ферменту “вимикається” з каталізу, та максимально можлива швидкість знижується. Тим не менш активні молекули ензиму можуть безперешкодно зв’язуватися з субстратом як при маленькій, так і при високій концентрації останнього. Отже, константа Міхаеліса залишається постійною.
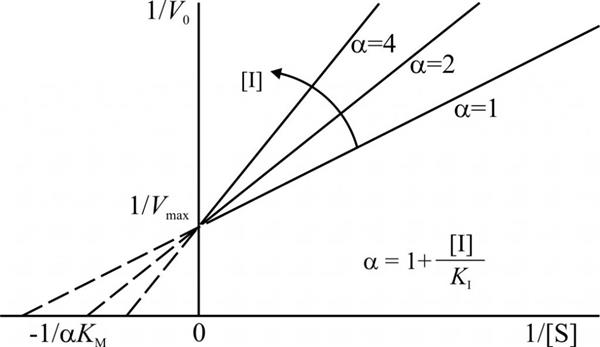
Графіки конкурентного інгібування в системі подвійних зворотних координат являють собою кілька прямих, що перетинають вісь ординат у точці 1/Vmax. Кожна пряма відповідає певній концентрації субстрату. Різні точки перетину з віссю абсцис (1/[S]) говорять про зміну константи Міхаеліса.