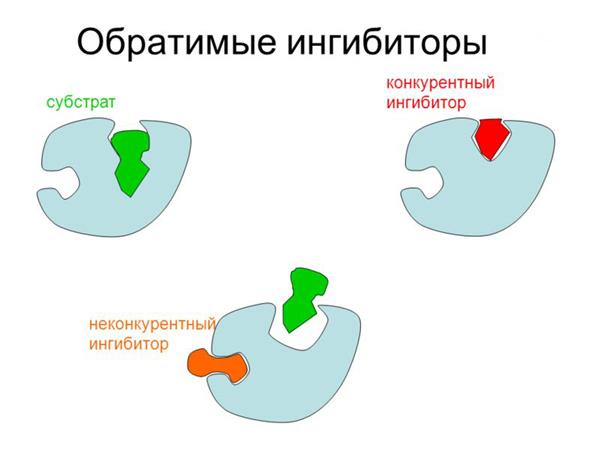
Механізм дії
Зв’язування інгібітора з активним центром перешкоджає утворення фермент-субстратного комплексу, необхідного для здійснення каталізу. В результаті молекула ензиму стає неактивною. Тим не менш каталітичний центр може зв’язатися не тільки з інгібітором, але і з субстратом. Ймовірність утворення того або іншого комплексу залежить від співвідношення концентрацій. Якщо молекул субстрату значно більше, то фермент буде реагувати з ними частіше, ніж з інгібітором.
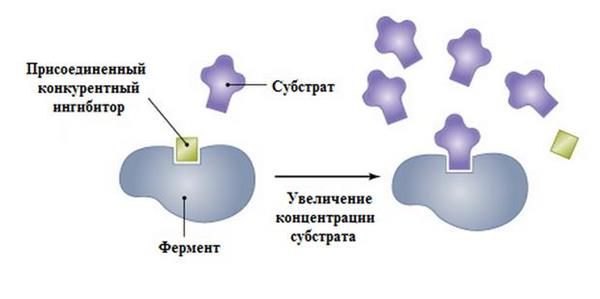
Вплив на швидкість хімічної реакції
Ступінь гальмування каталізу при конкурентному інгібуванні визначається тим, яка кількість ферменту будуть утворювати EI-комплекси. При цьому можна збільшити концентрацію субстрату до такої міри, що роль інгібітора буде витіснена, а швидкість каталізу досягне максимально можливого значення, відповідного величині Vmax по рівнянню Міхаеліса-Ментен.
Таке явище пояснюється сильним розбавленням інгібітора. Як наслідок, імовірність зв’язування з ним молекул ферменту зводиться до нуля, а активні центри реагують тільки з субстратом.