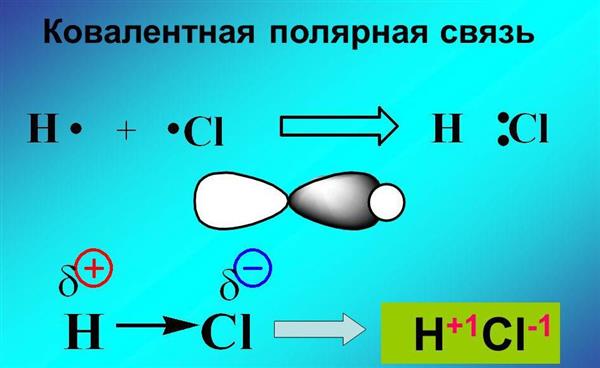
Ковалентний хімічний зв’язок є одним з видів зв’язку, завдяки якій утворюються молекули неорганічних і органічних речовин. Хімічна зв’язок з’являється при взаємодії електричних полів, які створюються ядрами і електронами атомів. Отже, утворення ковалентного хімічного зв’язку пов’язано з електричною природою.
Що таке зв’язок
Під цим терміном розуміють результат дії двох або більше атомів, які призводять до формування міцної многоатомной системи. Основні види хімічного зв’язку утворюються при зменшенні енергії реагуючих атомів. У процесі формування зв’язку атоми намагаються завершити свою електронну оболонку.
Види зв’язку
У хімії виділяють кілька видів зв’язку: іонної, ковалентного, металевої. Ковалентний хімічний зв’язок має два різновиди: полярна, неполярний.
Який механізм її створення? Ковалентний неполярний хімічний зв’язок утворюється між атомами однакових неметалів, які мають одну электроотрицательность. При цьому утворюються спільні електронні пари.