Формула метиламіну в хімії вважається майже примітивною. Однак для простих смертних одна назва цього з’єднання є загрозливим, не кажучи про те, що про структуру або формулою і зовсім нічого не відомо. Багатьом невідомо про специфічний запах даного з’єднання або про його надзвичайно широкі можливості застосування в різних виробництвах. Це цілком очевидно, адже все знати неможливо, і це факт. Але хіба не цікаво відкривати для себе щось раніше невідоме?
Що таке метиламин?
Метиламин – органічна сполука з формулою CH3NH2. Він є одним з похідних аміаку, належить до аліфатичних органічних речовин. Його відносять до вкрай вогненебезпечним сполук, так як цей газ легко змішується з повітрям, утворюючи при цьому вибухові суміші. Структура даної речовини представлена на малюнку нижче.
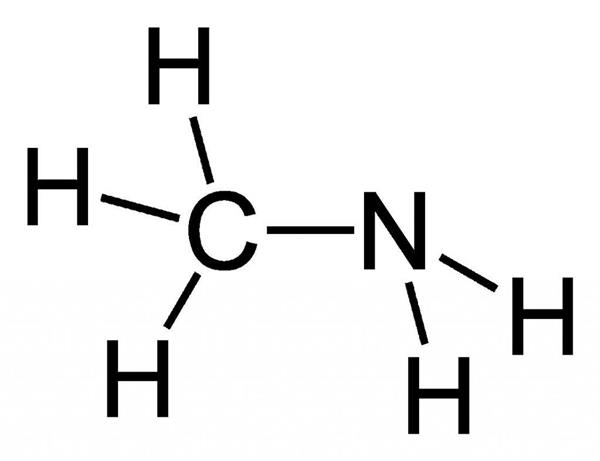
З назви очевидно, що дана речовина відноситься до такого класу органічних сполук, як аміни (а саме – первинні аміни), і воно є найпростішим його представником.
При нормальних умовах метиламин – це газ (як і згадувалося раніше), без кольору, але з яскраво вираженим запахом аміаку.
Інгаляція даними речовиною загрожує сильним подразненням шкіри, очей, верхніх дихальних шляхів. Здатен чинити негативний вплив на нирки і печінку організму. А вдихання його веде до порушення і подальшого пригнічення центральної нервової системи. Можливе настання смерті внаслідок зупинки дихання.

