Альдегіди – органічні речовини, які містять карбонильную групу >С=О, пов’язане хоча б з одним атомом водню. Альдегіди, а також схожих з ними за будовою і властивостями кетони, називають карбонильными, або оксосоединениями. Приклади альдегідів – мурашиний, оцтовий, пропионовый альдегід.
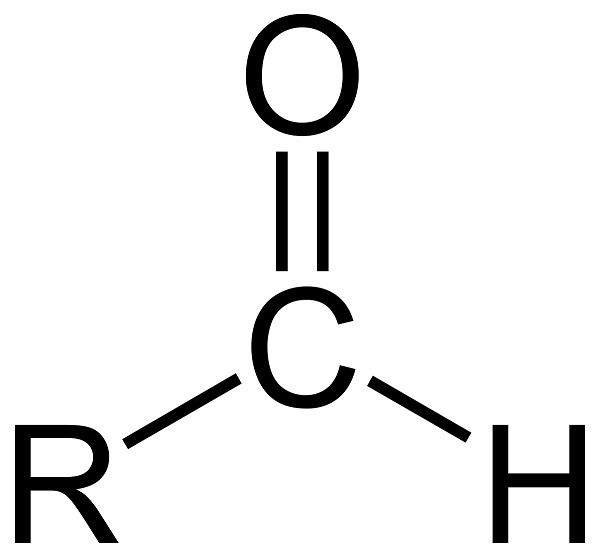
Номенклатура
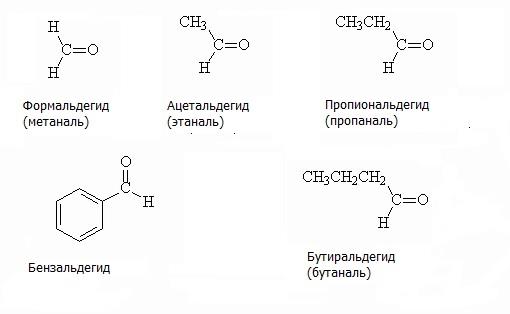
Тривіальні назви альдегідів утворюють з тривіальних назв споріднених карбонових кислот. Приклади альдегідів з назвами представлені на малюнку. Першим представником гомологічного ряду альдегідів є мурашиний альдегід або формальдегід, при окисленні якого утворюється мурашина кислота. Другий представник – оцтовий альдегід, ацетальдегід, при окисленні якого утворюється оцтова кислота.
За номенклатурою ІЮПАК альдегидную групу позначають суфіксом -аль, який додають до назви відповідного вуглеводню. Приклади альдегідів за номенклатурою ІЮПАК запропоновані на зображенні нижче.
Якщо у з’єднанні є старші групи, наприклад, карбоксильні, то наявність альдегідної групи позначають префіксом формил. Приклад альдегіду, який правильніше назвати дикарбоновой кислотою:
- НООС – СН (СНТ) – СН2 – СООН
Це 2-формилбутандиовая кислота.

