Третинної структурою білка називається спосіб укладання поліпептидного ланцюга в тривимірному просторі. Така конформація виникає за рахунок утворення хімічних зв’язків між віддаленими один від одного амінокислотними радикалами. Цей процес здійснюється за участю молекулярних механізмів клітини і грає величезну роль в доданні білків функціональної активності.
Особливості третинної структури
Для третинної структури білків характерні такі типи хімічних взаємодій:
- іонні;
- водневі;
- гідрофобні;
- ван-дер-ваальсові;
- дисульфідні.
Всі ці зв’язку (крім ковалентного дисульфидной) дуже слабкі, однак за рахунок кількості стабілізують просторову форму молекули.
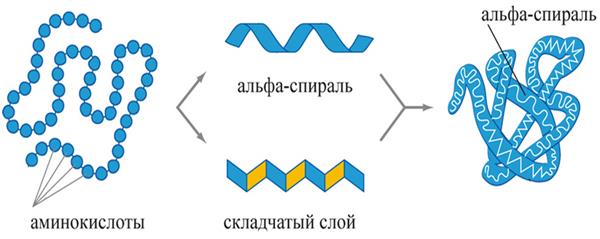
Фактично третій рівень укладання поліпептидних ланцюгів являє собою комбінацію різних елементів вторинної структури (α-спіралей; β-складчастих шарів і петель), які орієнтуються у просторі за рахунок хімічних взаємодій між бічними амінокислотними радикалами. Для схематичного позначення третинної структури білка α-спіралі позначаються циліндрами або спірально закрученими лініями, складчасті шари — стрілками, а петлі — простими лініями.
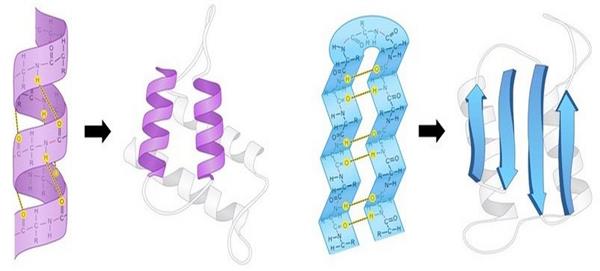
Характер третинної конформації визначається послідовністю амінокислот у ланцюзі, тому двом молекулам з однакової первинної структурою при рівних умовах буде відповідати один і той же варіант просторової укладки. Така конформація забезпечує функціональну активність білка і називається нативної.
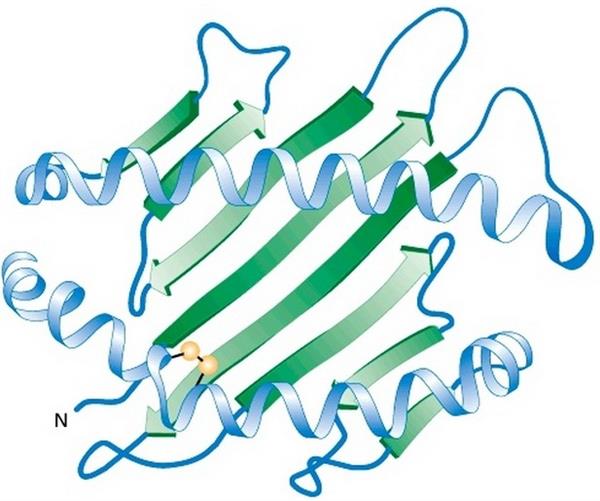
У процесі укладання білкової молекули відбувається зближення компонентів активного центру, які в первинній структурі можуть бути значно віддалені один від одного.
Для одноланцюгових білків третинна структура є кінцевою функціональною формою. Складні многосубъединичные білки утворюють четвертинну структуру, яка характеризує розташування декількох ланцюгів по відношенню один до одного.

