Характеристика хімічних зв’язків в третинній структурі білка
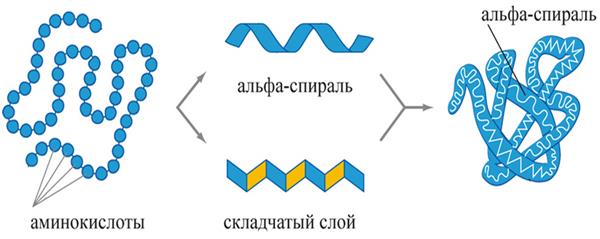
Значною мірою згортання поліпептидного ланцюга обумовлено співвідношенням гідрофільних і гідрофобних радикалів. Перші прагнуть вступити у взаємодію з воднем (складовим елементом води) і тому знаходяться на поверхні, а гідрофобні ділянки навпаки спрямовуються до центру молекули. Така конформація енергетично найбільш вигідна. В результаті формується глобула з гідрофобною серцевиною.
Гідрофільні радикали, які все-таки потрапляють в центр молекули взаємодіють один з одним з утворенням іонних або водневих зв’язків. Іонні зв’язки можуть виникати між протилежно зарядженими амінокислотними радикалами, в якості яких виступають:
- катіонні групи аргініну, лізину або гістидину (мають позитивний заряд);
- карбоксильні групи радикалів глутамінової та аспарагінової кислоти (мають негативний заряд).
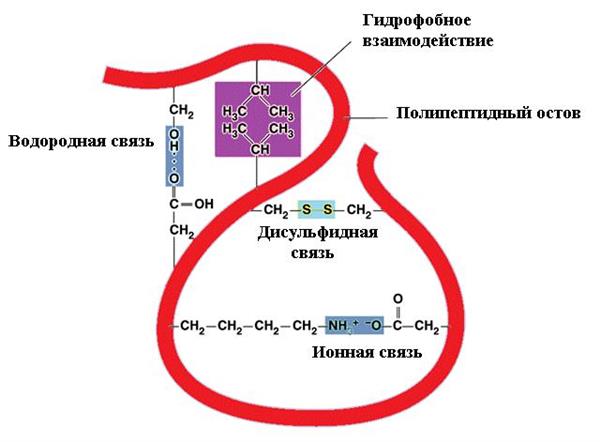
Водневі зв’язки утворюються при взаємодії незаряджених (OH, SH, CONH2) та заряджених гідрофільних груп. Ковалентні зв’язки (найміцніші у третинної конформації) виникають між SH-групами цистеиновых залишків, формуючи так звані дисульфідні містки. Зазвичай ці групи видалені один від одного в лінійній ланцюга і зближуються тільки в процесі укладання. Дисульфідні зв’язки, не характерні для більшості внутрішньоклітинних білків.