Як складається характеристика азоту за планом? 9 клас – це курс неорганічної хімії, в рамках якого школярі знайомляться з найважливішими елементами таблиці Менделєєва Д. І., а також з властивостями і областями застосування їх сполук. Існує певний алгоритм (план), за яким відбувається ознайомлення дев’ятикласників з представником певної групи елементів.
Послідовність дій
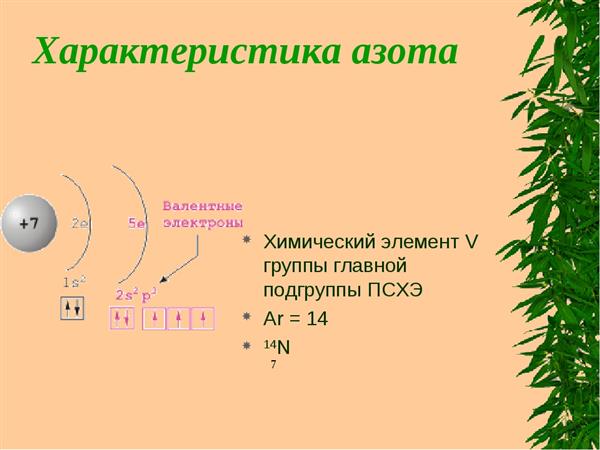
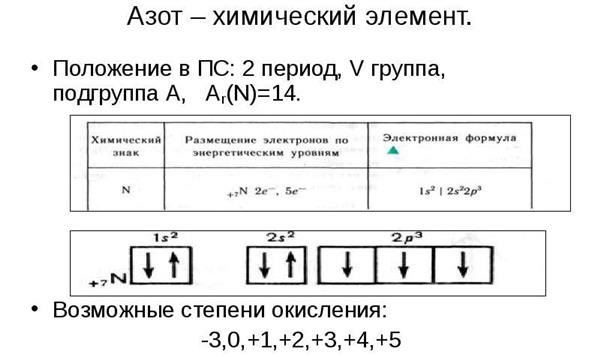
Що являє собою характеристика азоту? За планом (9 клас, Габрієлян О. С.) спочатку вказується:
- Положення в таблиці хімічних елементів. В даному пункті передбачається вказівка групи і підгрупи, періоду, валентностей і ступенів окислення, будова атома (число протонів, електронів, нейтронів), електронна конфігурація.
- Наступним пунктом є порівняння його хімічних властивостей (здатність приймати і віддавати електрони) з сусідніми по групі, періоду елементами. Для цього складають електронні конфігурації атомів, враховується радіус кожного, кількість електронів на зовнішньому енергетичному рівні.
- Далі оцінюється знаходження в природі, основні з’єднання.
- При описі фізичних властивостей враховуються всі модифікації (при їх наявності).
- При розгляді хімічних властивостей елемента характеризується відзначають умови протікання взаємодій.
- Важливе місце відводиться опису областей застосування самого елемента, а також його найважливіших сполук.