У 1861 році нещодавно винайдений фізичний метод дослідження речовин – спектральний аналіз – ще раз продемонстрував свою могутність і надійність, як запорука великого майбутнього в науці і техніці. З його допомогою було відкрито вже другий невідомий раніше хімічний елемент – рубідій. Потім, з відкриттям у 1869 році Д. І. Менделєєвим періодичного закону, рубідій разом з іншими елементами зайняв своє місце в таблиці, яка внесла порядок в хімічну науку.
Подальше вивчення рубідію показало, що цей елемент володіє цілим рядом цікавих і цінних властивостей. Ми розглянемо тут найбільш характерні й важливі з них.
Загальна характеристика хімічного елемента
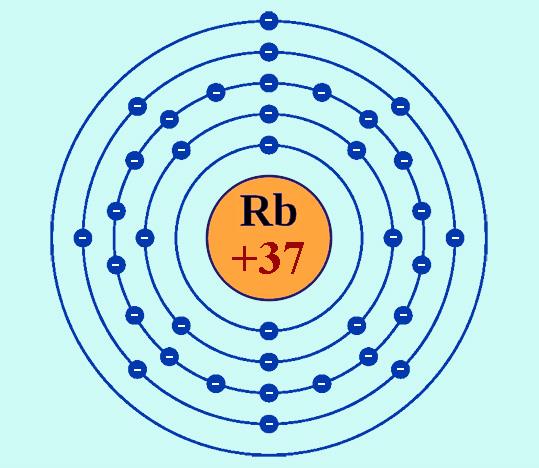
Рубідій має атомний номер 37, тобто в атомах його до складу ядер входить саме така кількість позитивно заряджених частинок – протонів. Відповідно нейтральний атом має 37 електронами.
Символ елемента – Rb. У періодичній системі рубідій класифікується як елемент I групи, період – п’ятий (в короткопериодном варіанті таблиці він належить до головної підгрупи I групи і розташований в шостому ряду). Є лужним металом, являє собою м’який, дуже легкоплавкое кристалічна речовина сріблясто-білого кольору.