На даний момент визначено більше п’ятисот тисяч неорганічних сполук. Класифікація та номенклатура неорганічних речовин – важливе питання, що дозволяє розбиратися в різноманітті сполук.
Історична довідка
У XVIII–XIX століттях Антуаном Лавуазьє, Михайлом Ломоносовим, Джоном Дальтоном була запропонована перша класифікація та номенклатура неорганічних речовин. Виділялися прості і складні речовини. Першу групу ділили на метали і неметали. Також виділяли групу сполук, які мали проміжні властивості, звані металоїдами. Це поділ лягло в основу сучасної класифікації.
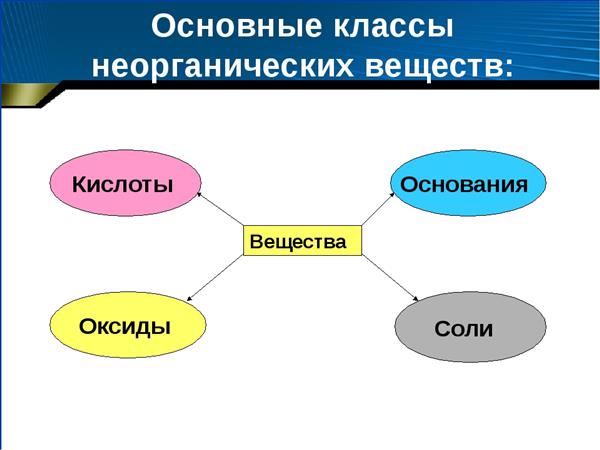
На даний момент виділяють чотири класи. Розглянемо докладніше кожен з цих класів.
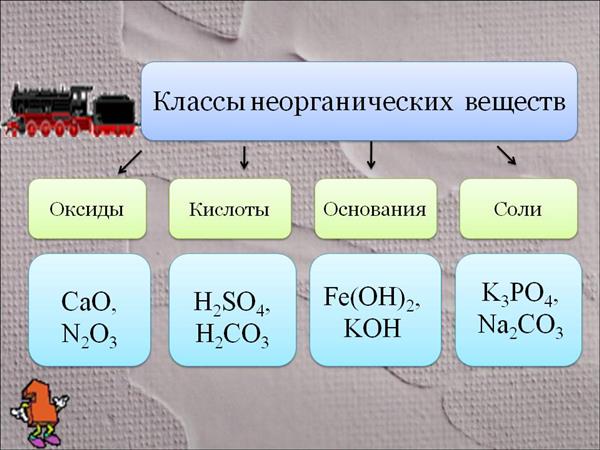
Оксиди
Ними є багатоатомні сполуки, які складаються з двох елементів, другим у них завжди знаходиться іон кисню в ступені окислення -2. Класифікація та номенклатура неорганічних речовин припускає підрозділ класу оксидів на три групи:
- основні;
- амфотерні;
- кислотні

