Усі біохімічні реакції, що протікають в організмі, схильні специфічного контролю, який здійснюється через активуючий або інгібуючий вплив на регуляторні ферменти. Останні зазвичай знаходяться в початку ланцюжків метаболічних перетворень і запускають багатоетапний процес, або гальмують його. Регулювання також піддаються деякі поодинокі реакції. Конкурентне інгібування є одним з основних механізмів контролю каталітичної активності ферментів.
Що таке інгібування?
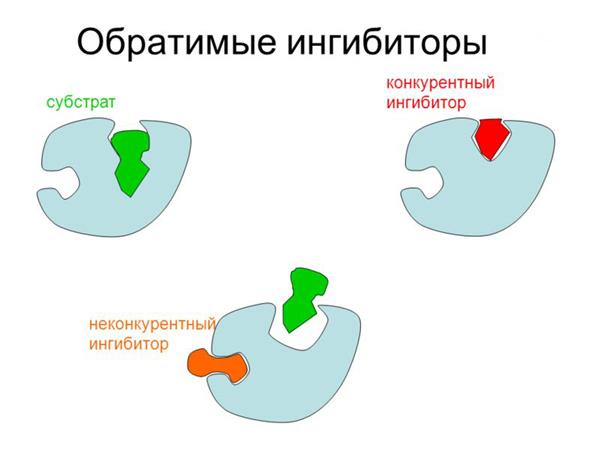
Механізм ферментативного каталізу заснований на зв’язуванні активного центру ензиму з молекулою субстрату (комплекс ES), в результаті чого відбувається хімічна реакція з утворенням і звільненням продукту (E+S = ES = EP = E+P).
Інгібуванням ферменту називають зниження швидкості або повну зупинку процесу каталізу. У більш вузькому значенні під цим терміном розуміють зменшення спорідненості до активного центру до субстрату, що досягається шляхом зв’язування молекул ензимів з речовинами-інгібіторами. Останні можуть діяти різними способами, на підставі чого поділені на кілька типів, яким відповідають однойменні механізми інгібування.