Попередники
До Бору вчені намагалися створити модель атома, засновану на постулатах класичної фізики. Найбільш успішна спроба належала Ернеста Резерфорду. В результаті численних дослідів він дійшов висновку про існування масивного атомного ядра, навколо якого рухаються по орбітах електрони. Оскільки графічно така модель була схожа на будову Сонячної системи, за нею закріпилась назва планетарної.

Але в ній був істотний недолік: атом, що відповідає резерфордовским рівнянь, виявився нестабільним. Рано чи пізно електрони, що рухалися з прискоренням по орбітах навколо ядра, повинні були впасти на ядро, а їх енергія витрачалася на електромагнітне випромінювання. Для Бору модель Резерфорда стала відправним пунктом у побудові власної теорії.
Перший постулат Бора
Головним нововведенням Бору стала відмова від використання класичної ньютонівської фізики в побудові теорії атома. Вивчивши отримані в лабораторії дані, він прийшов до висновку, що у світі елементарних частинок не працює такий важливий закон електродинаміки, як равноускоренное рух без хвильового випромінювання.
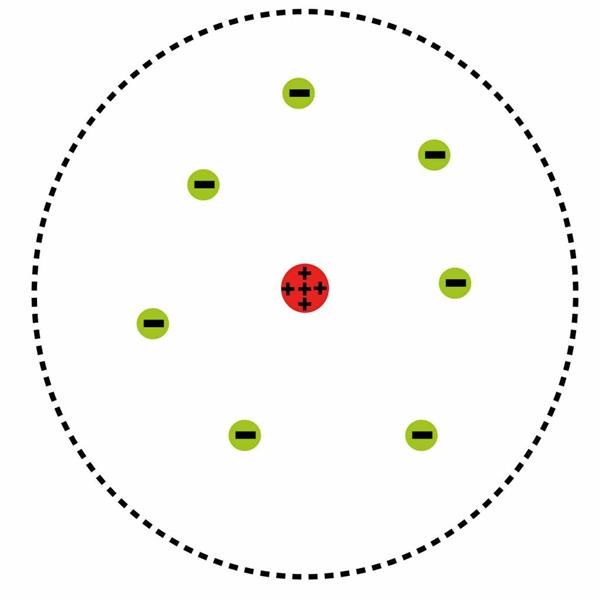
Підсумком його роздумів став закон, який звучить так: атомна система стабільна, тільки якщо вона знаходиться в одному з можливих стаціонарних (квантових) станах, кожному з яких відповідає певна енергія. Сенс цього закону, інакше званого постулатом квантових станів, що складається у визнанні відсутність електромагнітного випромінювання, що коли атом знаходиться в такому стані. Також наслідком першого постулату є визнання наявності енергетичних рівнів в атомі.