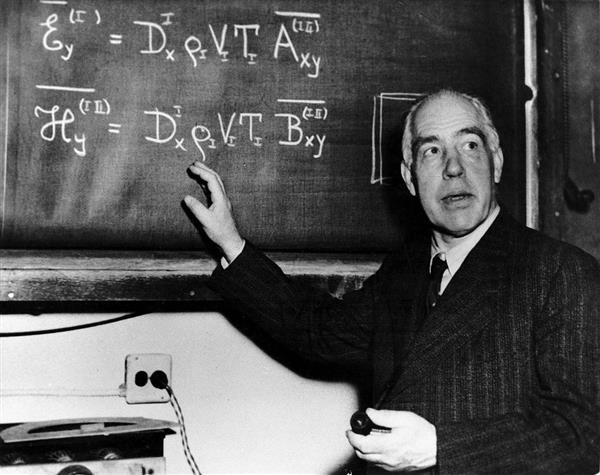Правило частот
Однак було очевидно, що атом не може весь час перебувати в одному і тому самому квантовому стані, оскільки стабільність заперечує будь-яка взаємодія, а значить, не було б ні Всесвіту, ні руху в ній. Позірна протиріччя дозволив другий постулат моделі будови атома Бора, відомий як правило частот. Атом здатний перейти з одного квантового стану в інший з відповідною зміною енергії, випромінюючи або поглинаючи при цьому квант, енергія якого дорівнює різниці енергій стаціонарних станів.
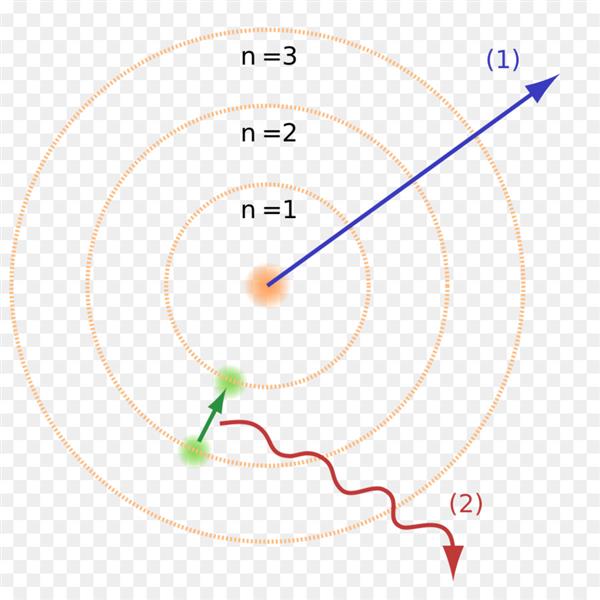
Другий постулат теж суперечить класичній електродинаміці. Згідно теорії Максвелла, характер руху електрона не може впливати на частоту його випромінювання.
Спектр атома
Квантова модель Бора стала можливою завдяки ретельному вивченню спектра атома. Довгий час вчених бентежило, що замість очікуваної безперервної колірної області, одержуваної при вивченні спектрів небесних світил, спектрограма атома була переривчастою. Лінії яскравого кольору не переходили один в одного, а поділялися значними темними ділянками.

Теорія переходу електрона з одного квантового стану в інший пояснювала цю дивину. Коли електрон переходив з одного енергетичного рівня на інший, де від нього була потрібна менша енергія, він випускав квант, що відбивалося на спектрограмме. Теорія Бора відразу ж продемонструвала здатність до прогнозування подальших змін в спектрах простих атомів начебто водню.