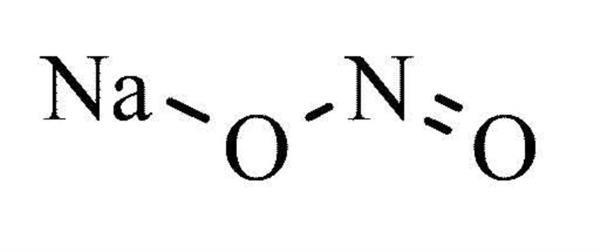Окисно-відновні властивості
Атом азоту нітрит-іони має проміжний заряд +3, ось чому для нітритів характерні як окислювальні, так і відновні властивості. Наприклад, нітрити будуть знебарвлювати розчин калію перманганату в кислому середовищі, виявляючи властивості окислювача:
5KNO2 + 2KMnO4 +3H2SO4 = 3H2O + 5KNO3 + 2MnSO4 + K2SO4
Властивості відновника нітрит-іони проявляють, наприклад, у реакції з міцним розчином пероксиду водню:
NO2- + H2O2 = NO3- + H2O
Відновником є нітрит при взаємодії з броматом срібла (підкислений розчин). Ця реакція використовується в хімічному аналізі:
2NO2- + Ag+ + BrO2- = 2NO3- + AgBr↓
Ще одним прикладом відновлювальних властивостей є якісна реакція на нітрит-іон — взаємодія безбарвних розчинів [Fe(H2O)6]2+ з підкисленім розчином нітриту натрію з появою бурого фарбування.