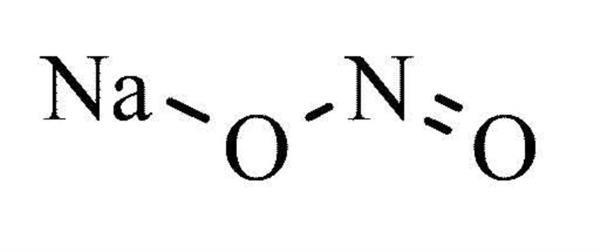Теоретичні основи виявлення NO2
Азотиста кислота при нагріванні диспропорционирует з утворенням оксиду азоту (II) і азотної кислоти:
HNO2 + 2HNO2 = NO3- + H2O + 2NO↑ + H+
Тому азотисту кислоту неможливо відокремити від азотної кип’ятінням. Як видно з рівняння, азотиста кислота, розкладаючись, частково перетворюється в азотну, що призведе до помилок у визначенні вмісту нітратів.
Майже всі нітрити розчиняються у воді, найменш розчинним з цих сполук є нітрит срібла.
Нітрит-іон сам безбарвний, тому його виявляють реакціями утворення інших забарвлених сполук. Нітрити нефарбованих катіонів також безбарвні.

Якісні реакції
Існує кілька якісних способів визначення нітрит-іонів.
1. Реакція утворення K3[Co(NO2)6].
У пробірку вміщують 5 крапель досліджуваного розчину, що містить нітрит, 3 краплі розчину нітрату кобальту, 2 краплі оцтової кислоти (розведеної), 3 краплі розчину хлориду калію. Утворюється гексанитрокобальтат (III) K3[Co(NO2)6] – жовтий кристалічний осад. Нітрат-іон в досліджуваному розчині не заважає виявленню нітритів.
2. Реакція окислення йодидів.
Нітрит-іони окислюють йодид-іони в кислому середовищі.
2HNO2 + 2I- + 2H+ = 2NO↑ + I2↓ + 2H2O
У ході реакції утворюється елементарний йод, який легко виявити фарбуванням крохмалю. Для цього реакцію можна проводити на фільтрувальному папері, попередньо просоченої крохмалем. Реакція дуже чутлива. Синій колір з’являється навіть при наявності слідів нітритів: відкривається мінімум – 0,005 мкг.
Фільтрувальний папір просочують крохмальним розчином, на неї додають 1 краплю 2н розчину оцтової кислоти, 1 краплю дослідного розчину, 1 краплю 0,1 н розчину иодида калію. При наявності нітриту з’являється синє кільце або пляму. Виявлення заважають інші окислювачі, що призводять до утворення йоду.
3. Реакція з перманганатом калію.
У пробірку поміщають 3 краплі розчину калію перманганату , 2 краплі сірчаної кислоти (розведеної). Суміш потрібно нагріти до 50-60 °С. обережно Додають кілька крапель нітриту натрію або калію. Розчин перманганату знебарвлюється. Інші відновники, присутні в досліджуваному розчині, здатні окислити перманганат-іон, будуть заважати виявленню NO2-.
4. Реакція з сульфатом заліза (II).
Сульфат заліза відновлює нітрит в нітрат в кислому середовищі (розбавлена сірчана кислота):
2KNO2 (тв.) + 2H2SO4 (разб.) + 2FeSO4 (тв.) = 2NO↑ + K2SO4 + Fe2(SO4)3 + 2H2O
Отриманий оксид азоту (II) утворює з надлишком Fe2+ (не встигли ще вступити в реакцію) комплексні іони бурого кольору:
NO + Fe2+ = [FeNO]2+
NO + FeSO4 = [FeNO]SO4
Слід врахувати, що з розбавленою сірчаною кислотою реагують нітрити, а з концентрованою будуть реагувати нітрати. Тому для виявлення нітрит-іона необхідна саме розбавлена кислота.
5. Реакція з антипірином.
NO2 – з антипірином в кислому середовищі дає розчин зеленого кольору.
6. Реакція з риванолом.
NO2 – з риванолом, або этакридином (I) в кислому середовищі дає розчин червоного кольору.