Наприкінці XVIII та в першій половині XIX століття вчені різних країн активно вивчали поведінку газоподібної, рідкої і твердої матерії при різних зовнішніх умовах, спираючись у своїх дослідженнях на уявлення про атомному і молекулярному будову речовини. Одним з таких вчених був британець Джон Дальтон. Закон для суміші газів, який в даний час носить його прізвище, розглядається в даній статті.
Особливі умови
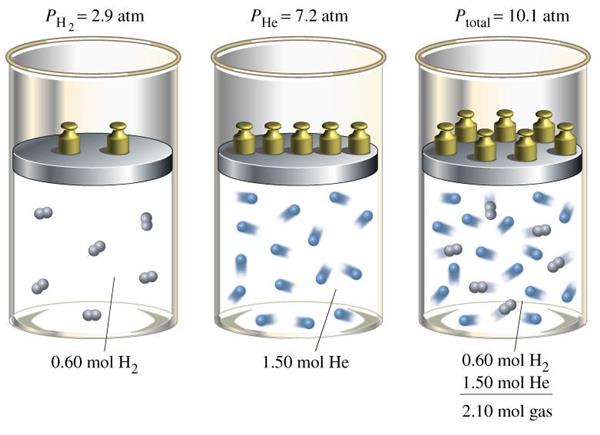
Перш ніж формулювати закон Дальтона для суміші газів, слід розібратися з одним із понять. Це дуже важливо, оскільки тільки для такої речовини справедливий цей закон. Мова йде про ідеальному газі. Що ж це таке?
Під ідеальним покладається газ, для якого справедливі наступні вимоги:
- розміри молекул і атомів в ньому настільки малі, що їх можна вважати матеріальними точками, що мають нульовий обсяг;
- молекули і атоми не взаємодіють між собою.
Таким чином, ідеальний газ представляє собою сукупність матеріальних точок, які рухаються хаотично. Швидкість їх руху і маса однозначно визначають температуру всієї суміші. Тиск, що досліджувана речовина впливає на стінки посудини, залежить від таких макроскопічних параметрів, як температура, об’єм посудини і число молекул.
Для такої газової моделі справедливо рівність:
P*V = n*R*T
Воно називається рівнянням стану і об’єднує тиск (P), температуру (T), обсяг (V) і кількість речовини в молях (n). Величина R – це коефіцієнт пропорційності, який дорівнює 8,314 Дж/(К*моль).
Дивне в цій формулі те, що вона не включає жодного параметра, який би залежав від хімічної природи молекул і атомів.
Ідеальними можна вважати практично будь-які гази та їх суміші, якщо температура не дуже низька, а тиск не надто велике. Зверніть увагу! Кімнатна температура і атмосферний тиск потрапляють в ці межі.