Молекула води
Щоб повніше уявити собі, яким чином відбувається кристалізація води, необхідно знати, як влаштована молекула цієї хімічної сполуки, адже будова молекули обумовлює особливості зв’язків, які вона утворює.
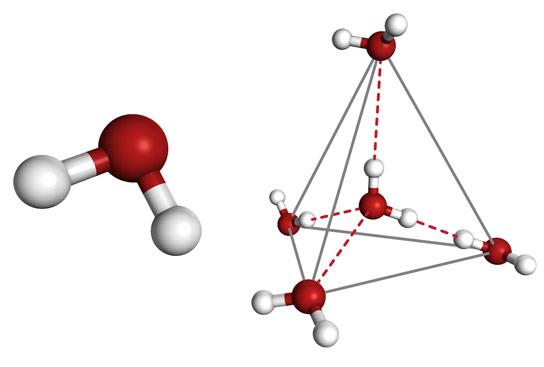
В молекулі води об’єднані один атом кисню і два атоми водню. Вони формують тупокутний рівнобедрений трикутник, в якому атом кисню розташований у вершини тупого кута величиною 104,45°. При цьому кисень сильно відтягує електронні хмари в свою сторону, так що молекула являє собою електричний диполь. Заряди в ньому розподілені по вершин уявної чотиригранної піраміди – тетраедра з внутрішніми кутами приблизно 109°. Унаслідок цього молекула може утворювати за чотири водневих (протонних) зв’язку, що, зрозуміло, впливає на властивості води.
Особливості структури рідкої води і льоду
Здатність молекули води до формування протонних зв’язків проявляється і в рідкому, і в твердому стані. Коли вода – рідина, що зв’язки ці досить нестійкі, легко руйнуються, але постійно утворюються знову. Завдяки наявності їх молекули води пов’язані між собою сильніше, ніж частинки інших рідин. Асоціюючись, вони формують особливі структури – кластери. З цієї причини фазові точки води зміщені в бік більш високих температур, адже для руйнування таких додаткових асоціатів теж потрібна енергія. Причому енергія досить значна: не будь водневих зв’язків і кластерів, температура кристалізації води (а також її плавлення) склала б -100 °C, а кипіння +80 °C.
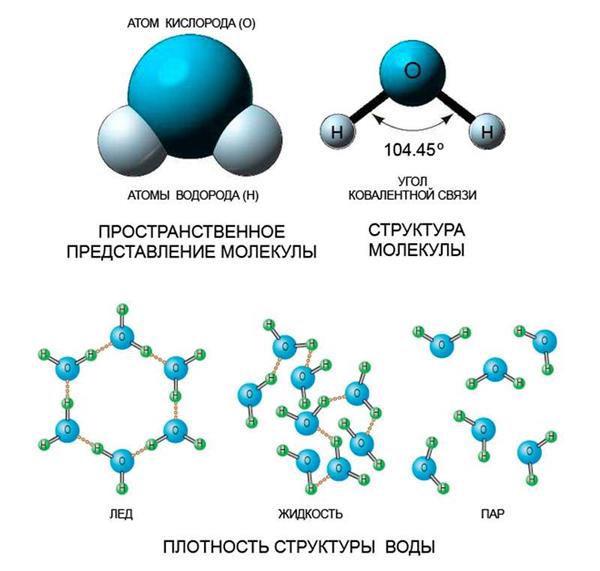
Будова кластерів ідентично будови кристалічного льоду. Зв’язуючись кожна з чотирма сусідками, молекули води вибудовують ажурну кристалічну структуру з основою у формі шестикутника. На відміну від рідкої води, де мікрокристали – кластери – непостійні і рухливі із-за теплового руху молекул, при утворенні льоду вони перебудовуються стійким і регулярним чином. Водневі зв’язки фіксують взаємне розташування вузлів кристалічної решітки, і в результаті відстань між молекулами стає трохи більше, ніж в рідкій фазі. Цією обставиною пояснюється стрибок щільності води при її кристалізації – щільність падає з майже 1 г/см3 до приблизно 0,92 г/см3.

